Module 1.2 Bloedafname en injecties
Uitgangsvraag
Wat is de plaats van huiddesinfectie voorafgaand aan een bloedafname en een injectie (intramusculair, subcutaan, intradermaal) en welk huiddesinfectiemiddel heeft hierin de voorkeur op het voorkómen van een (lokale/systemische) infectie bij de patiënt en op het reduceren van het risico op contaminatie van het bloedmonster (in geval van bloedafname)?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de plaats van huiddesinfectie voorafgaand aan bloedafname ten behoeve van diagnostiek/keuringen op het voorkómen van een (lokale/systemische) infectie bij de patiënt?
- Wat is de plaats van huiddesinfectie bij een patiënt voorafgaand aan een intramusculaire, subcutane of intradermale injectie op het voorkómen van een infectie bij de patiënt?
- Welk huiddesinfectiemiddel heeft de voorkeur om voorafgaand aan een bloedafname en/of een injectie (intramusculair, subcutaan, intradermaal) te gebruiken, om een infectie bij de patiënt te voorkómen en in geval van bloedafname het risico op contaminatie van het bloedmonster te reduceren?
Aanbevelingen
Aanbeveling 1
- Voorafgaand aan een bloedafname wordt huiddesinfectie aanbevolen.
Aanbeveling 2
- Huiddesinfectie voorafgaand aan een intramusculaire, subcutane of intradermale injectie is niet noodzakelijk. Hiervan kan gemotiveerd worden afgeweken.
Aanbeveling 3
- Desinfecteer de huid voorafgaand aan een bloedafname met een oplossing van chloorhexidine 0,5% in alcohol 70%.
- Indien er op indicatie huiddesinfectie wordt toegepast bij een intramusculaire, subcutane of intradermale injectie wordt hetzelfde middel als bij bloedafname aanbevolen.
Overwegingen
Deelvraag 1
Plaats van huiddesinfectie voorafgaand aan bloedafname
Voor deze module is systematisch gezocht naar wetenschappelijke literatuur om de volgende uitgangsvraag te beantwoorden: wat is de plaats van huiddesinfectie voorafgaand aan bloedafname ten behoeve van diagnostiek/keuringen op het voorkómen van een (lokale/systemische) infectie bij de patiënt? Uit de literatuursearch kwam geen studie naar voren die antwoord kon geven op deze uitgangsvraag. Dit kennishiaat is als kennislacune opgenomen binnen deze richtlijn. De hierna benoemde informatie is gebaseerd op de WHO- guidelines on drawing blood: best practices in phlebotomy en expert opinion.
Pathogenese
Aangenomen wordt dat het doorbreken van de huidbarrière voor bloedafname in potentie kan leiden tot een (lokale of systemische) infectie met huidflora waaronder bijvoorbeeld een Staphylococcus aureus omdat ook bij een bloedafname bacteriën kunnen worden ingebracht.
Internationale richtlijnen
In de WHO-richtlijn WHO guidelines on drawing blood: best practices in phlebotomy uit 2010 worden stapsgewijs de ‘best practices’ ten behoeve van infectiepreventie bij het uitvoeren van een venapunctie beschreven. Globaal wordt hieronder verstaan: een veilige locatie waar de bloedafnames kunnen plaatsvinden, kennis en kunde van de laborant die de venapunctie uitvoert, up-to-date protocollen en een lijst met instructies hoe de venapunctie daadwerkelijk uit te voeren. Bij gebrek aan bewijs is een panel van experts geraadpleegd om een advies uit te brengen ten aanzien van het al dan niet desinfecteren van de huid voorgaand aan een venapunctie. Gebaseerd op expert opinion, en rekening houdende met gebruikersgemak en lage kosten, is het advies van de WHO om desinfectie toe te passen in dit geval. De CDC (Centers for Disease Control and Prevention) refereert eveneens aan dezelfde richtlijn van de WHO.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor patiënten is het van belang dat iedere medische handeling veilig plaatsvindt. Elk risico wat zou kunnen bijdragen aan het ontstaan van een (zorggerelateerde) infectie zou moeten worden beperkt tot het minimum. Dit houdt in dat het de plicht is van de zorgmedewerker om invasieve handelingen zoals een bloedafname op een zo veilig mogelijke manier uit te voeren. Hierbij is het van belang dat zorgmedewerkers die bloedafnames uitvoeren juist geschoold zijn en dat zij beschikken over de actuele protocollen met bijbehorende werkwijze.
Kosten (middelenbeslag)
De zorginstelling is verantwoordelijk voor de kosten van de noodzakelijke middelen die beschikbaar dienen te zijn voor het op de juiste manier uitvoeren van een bloedafname. De kosten van deze middelen zullen naar verwachting geen bepalende rol spelen in het al dan niet beschikbaar stellen hiervan, zelfs als de bloedafname wordt verricht buiten de afdeling bloedafname van een ziekenhuis, zorginstelling dan wel perifeer laboratorium.
Aanvaardbaarheid, haalbaarheid en implementatie
Omdat een bloedafname een handeling is die op gestandaardiseerde wijze met de daarbij behorende middelen dient plaats te vinden, zal de setting waarin deze plaatsvindt geen rol spelen. Mochten er bloedafnames verricht moeten worden buiten de afdeling bloedafname van een ziekenhuis, zorginstelling dan wel perifeer laboratorium, dan is de verwachting dat de hiervoor beschikbare middelen aanwezig zullen zijn en tenminste ter beschikking zijn gesteld aan de uitvoerder hiervan. Er zijn geen beperkende factoren te benoemen die een gestandaardiseerde werkwijze tegengaan. Daarnaast wordt ingeschat door de werkgroep dat vele ziekenhuizen er momenteel voor kiezen om de huid te desinfecteren voorafgaand aan een bloedafname. Gesteund door het feit dat er geen discussie bestaat over het desinfecteren van de huid voorgaand aan een bloedafname in het kader van bloedkweken, in het geval van bloedtransfusie of bij het inbrengen van een intravasculaire katheter ter voorkoming van een lokale dan wel systemische infectie verwacht de werkgroep geen barrières voor aanvaardbaarheid, haalbaarheid en implementatie.
Duurzaamheid
Bij het gebruik van desinfectiemiddelen is het belangrijk dat organisaties middelen inkopen op basis van de behoefte van de instellingen en dat er geen te grote voorraad aangelegd wordt. Hiermee wordt voorkomen dat middelen weggegooid moeten worden omdat de houdbaarheidsdatum is verstreken. Daarnaast kunnen instellingen in hun aanschaf rekening houden met productie, transport en gebruik van verpakkingsmateriaal.
Deelvraag 2
Plaats van huiddesinfectie voorafgaand aan injectie (intramusculair, subcutaan, intradermaal)
Voor deze module is systematisch gezocht naar wetenschappelijke literatuur om de volgende uitgangsvraag te beantwoorden: Wat is de plaats van huiddesinfectie bij een patiënt voorafgaand aan een intramusculaire, subcutane of intradermale injectie op het voorkómen van een infectie bij de patiënt? Uit de search kwamen drie studies naar voren (Wong, 2019; Khawaja, 2013; Koivisto, 1978). De in deze studies onderzochte patiëntenpopulatie waren echter niet groot genoeg en hadden een te korte follow-up om een infectie te kunnen detecteren (geen infecties aangetoond), waardoor het niet mogelijk is om de bewijskracht van deze studies te beoordelen. Het is dan ook niet mogelijk om op grond hiervan een conclusie te trekken en daarom baseert de werkgroep op expert opinion en andere ondersteunende literatuur.
Voordelen van het desinfecteren van de huid voorafgaand aan een intramusculaire, subcutane of intradermale injectie is het verlagen van de bacterieload met als doel het risico op een lokale of systemische infectie door het introduceren van een bacterie met de naald te verkleinen. De studie van Khawaja (2013) toont alleen aan dat huiddesinfectie het aantal CFU significant vermindert. Nadelen van desinfectie van de huid zijn, naast de (lage) kosten voor de desinfectiemiddelen en de aanschaf van bijbehorende hulpmiddelen, eventuele overgevoeligheidsreacties van de patiënt voor het huiddesinfectiemiddel.
Een subgroepanalyse voor patiënten met een hoger risico op het ontwikkelen van een infectie, of een potentieel slechtere uitkomst bij het doormaken van een infectie is op basis van de huidige literatuur niet te maken. Het is niet uitgesloten dat in bijvoorbeeld immuungecompromitteerde patiënten er alsnog een voordeel is van huid desinfectie voorafgaand aan een intramusculaire, subcutane of intradermale injectie.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Bij een voorkeur van een patiënt vóór desinfectie van de huid voorafgaand aan een intramusculaire, subcutane of intradermale injectie is te overwegen om deze handeling toe te passen.
Kosten (middelenbeslag)
De kosten van een huiddesinfectiemiddel en de benodigde hulpmiddelen zijn laag, en deze zijn geen overweging in de beslissing wel of geen huiddesinfectie toe te passen voorafgaand aan een intramusculaire, subcutane of intradermale injectie.
Aanvaardbaarheid, haalbaarheid en implementatie
In de praktijk wordt wisselend omgegaan met het al dan niet desinfecteren van de huid voorafgaand aan een injectie. Zorgmedewerkers die gewend waren om standaard wel de huid te desinfecteren, kunnen mogelijk moeite hebben om deze werkwijze te veranderen. Echter grote problemen bij de aanvaardbaarheid, haalbaarheid en implementatie worden niet verwacht, omdat zorgmedewerkers kunnen besluiten om op indicatie wel huiddesinfectie toe te passen.
Duurzaamheid
Het is van belang om alleen de huid voorafgaand aan een injectie te desinfecteren wanneer hiervoor een indicatie bestaat. Hiermee wordt onnodig verbruik van huiddesinfectiemiddelen voorkómen.
Deelvraag 3
Huiddesinfectiemiddelen voorafgaand aan bloedafname en injectie
Voor deze module is systematisch gezocht naar wetenschappelijke literatuur om de volgende uitgangsvraag te beantwoorden: welk huiddesinfectiemiddel heeft de voorkeur om voorafgaand aan een bloedafname en/of een injectie te gebruiken, om een infectie bij de patiënt te voorkómen en in geval van bloedafname ook te voorkómen dat het bloedmonster gecontamineerd wordt met huidflora? Hieruit zijn zeven studies geïncludeerd waarbij gekeken is naar de uitkomstmaat contaminatie van het bloedmonster bij patiënten die werden verdacht van een bloedbaaninfectie/bacteriemie. De genoemde studies vergeleken telkens verschillende huiddesinfectiemiddelen en er werden verschillende methoden beschreven.
De kwaliteit van het bewijs is beoordeeld als laag tot zeer laag waarin verschillende middelen en methoden zijn vergeleken. De conclusie is dan ook dat er op basis van de wetenschappelijke literatuur geen richting gegeven kan worden aan de besluitvorming welk middel/welke middelen de voorkeur hebben voor desinfectie van de huid om het risico op contaminatie van bloedkweken te reduceren.
Voor de uitkomstmaat infectie en bijwerkingen konden geen studies worden geïncludeerd.
De werkgroep is van mening dat de meeste ziekenhuizen de huid voorafgaand aan een bloedafname desinfecteren met een chloorhexidine (0,5%) in alcohol* (70%) oplossing. Dit middel is in het algemeen goed verkrijgbaar en meest gangbaar in ziekenhuizen als huiddesinfectiemiddel. Ook is dit in lijn met het huiddesinfectiemiddel welke wordt aanbevolen bij ingrepen. Daar waar huiddesinfectie bij een intramusculaire, subcutane of intradermale injectie op indicatie wordt toegepast, ziet de werkgroep geen redenen om een ander middel toe te passen dan bij bloedafname.
*Chloorhexidine is in een oplossing verkrijgbaar in zowel water, als ethanol/isopropylalcohol. 0,5% chloorhexidine in alcohol opgelost betreft altijd ethanol. Een hoger percentage chloorhexidine (2%) in alcohol opgelost betreft isopropylalcohol (Chloraprep of Soluprep) (CBG/EMA).
In het geval van overgevoeligheid/allergie voor chloorhexidine kan voor een desinfectans gekozen worden op basis van jodium (bijvoorbeeld povidonjodium of jodiumtinctuur).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor patiënten is het van belang dat iedere medische handeling veilig plaatsvindt, in dit geval het desinfecteren van de huid voorafgaand aan een bloedafname. Verwacht wordt dat patiënten geen voorkeur zullen hebben voor een huiddesinfectiemiddel, behalve als sprake blijkt te zijn van een allergie/overgevoeligheidsreactie.
Kosten (middelenbeslag)
De kosten van een huiddesinfectiemiddel zullen naar verwachting geen bepalende rol spelen in het al dan niet beschikbaar stellen hiervan, zelfs als de bloedafname wordt verricht buiten de afdeling bloedafname van een ziekenhuis, zorginstelling dan wel perifeer laboratorium.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen beperkende factoren te benoemen die een gestandaardiseerde werkwijze rondom bloedafname tegengaan. De werkgroep verwacht dan ook geen barrières voor aanvaardbaarheid, haalbaarheid en implementatie.
Duurzaamheid
Bij het gebruik van huiddesinfectiemiddelen is het belangrijk dat organisaties middelen inkopen op basis van de behoefte van de instellingen en dat er geen te grote voorraad aangelegd wordt. Hiermee wordt voorkomen dat middelen weggegooid moeten worden omdat de houdbaarheidsdatum is verstreken. Daarnaast kunnen instellingen in hun aanschaf rekening houden met productie, transport en gebruik van verpakkingsmateriaal.
Rationale van de aanbevelingen
Aanbeveling 1
Plaats van huiddesinfectie voorafgaand aan bloedafname
Bij het gebrek aan wetenschappelijk bewijs, baseert de werkgroep de aanbeveling enkel op het advies wat beschreven is in de WHO-richtlijn. De voordelen van de eenvoudige handeling wat desinfecteren van de huid betreft en de lage kosten die het met zich meebrengt wegen zwaarder dan de negatieve gevolgen van een (lokale of systemische) infectie met huidflora waaronder bijvoorbeeld Staphylococcus aureus. Daarnaast wordt ingeschat dat vele ziekenhuizen er momenteel voor kiezen om de huid te desinfecteren voorafgaand aan bloedafname, ongeacht de reden voor bloedafname. Ten slotte, gesteund door het feit dat er geen discussie bestaat over het feit dat de huid voorgaand aan bloedafname ten behoeve van bloedkweken, bloedtransfusie of het inbrengen van een intravasculaire katheter gedesinfecteerd dient te worden ter voorkoming van een lokale dan wel systemische infectie, komt de werkgroep met deze aanbeveling.
Aanbeveling 2
Plaats van huiddesinfectie voorafgaand aan injectie (intramusculair, subcutaan, intradermaal)
In geen van de beschikbare studies zijn er lokale of systemische infecties gevonden in zowel de controle als interventie groep. Op basis hiervan kan geen richting worden gegeven aan de aanbeveling. Wel toont de studie van Khawaja (2013) aan dat huiddesinfectie het aantal CFU significant vermindert. De werkgroep sluit daarom niet uit dat huiddesinfectie bij bijvoorbeeld immuungecomprommitteerde patiënten alsnog een voordeel oplevert. Daarom is de werkgroep van mening dat huiddesinfectie op indicatie toegepast kan worden, rekening houdend met eventuele overgevoeligheidsreacties van de patiënt op een huiddesinfectiemiddel.
Aanbeveling 3
Huiddesinfectiemiddelen voorafgaand aan bloedafname en injectie
Gezien het feit dat de bewijskracht van de literatuur als zeer laag is beoordeeld, kan er geen huiddesinfectiemiddel van voorkeur aangegeven worden. De werkgroep baseert de aanbeveling dan ook op de huidige praktijk en op het eerder door de WIP beschreven advies. Bij navraag aan de werkgroepleden blijkt dat de meeste ziekenhuizen de huid voorafgaand aan een bloedafname desinfecteren met een chloorhexidine (0,5%) in alcohol (70%) oplossing. Ook is dit in lijn met het huiddesinfectiemiddel welke wordt aanbevolen bij ingrepen.
Daar waar huiddesinfectie bij een intramusculaire, subcutane of intradermale injectie op indicatie wordt toegepast, ziet de werkgroep geen redenen om een ander middel toe te passen dan bij bloedafname.
Onderbouwing
Autorisatiedatum: 29 augustus 2024
Eerstvolgende beoordeling actualiteit: 2026
Initiatief:
- Samenwerkingsverband Richtlijnen Infectiepreventie (SRI)
Geautoriseerd door:
- Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV)
- Nederlandse Vereniging voor Heelkunde (NVvH)
- Nederlands Oogheelkundig Gezelschap (NOG)
- Nederlandse Orthopaedische Vereniging (NOV)
- Nederlandse Vereniging voor Reumatologie (NVR)
- Nederlandse Vereniging voor Thoraxchirurgie (NVT)
- Nederlandse Vereniging voor Kindergeneeskunde (NVK)
- Nederlandse Vereniging van Arbeidshygiëne (NVvA)
- Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg (VHIG)
- Patiëntenfederatie Nederland (PFNL)
Regiehouder:
- Samenwerkingsverband Richtlijnen Infectiepreventie
De ontwikkeling/herziening van deze richtlijnmodule is ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en is gefinancierd door het ministerie van VWS (Ministerie van Volksgezondheid, Welzijn en Sport). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Wanneer de huidbarrière wordt doorbroken, kunnen bacteriën worden geïntroduceerd met het risico op het ontstaan van een infectie. Een van de maatregelen om het risico op een infectie te verminderen is het desinfecteren van de huid voorafgaand aan het moment dat deze barrière door medisch handelen wordt doorbroken.
In de praktijk bestaat er vanuit infectiepreventie-oogpunt discussie over het nut en de noodzaak van huiddesinfectie voorafgaand aan bloedafname ten behoeve van diagnostiek inclusief keuringen. Dit in tegenstelling tot wanneer er bloed wordt afgenomen ten behoeve van bloedkweken, bloedtransfusie of wanneer de huidbarrière wordt doorbroken bij het inbrengen van een intravasculaire katheter waarbij het nut en de noodzaak voor huiddesinfectie wel wordt gezien.
Ook bestaat er al langere tijd discussie over het feit of huiddesinfectie nodig is voorafgaand aan het toedienen van medicatie (waaronder ook vaccinatie, insuline) via een intramusculaire, subcutane of intradermale injectie.
Ook zijn er in de praktijk verschillende middelen die worden gebruikt voor desinfectie van de huid voorafgaand aan bloedafname of injectie. Gezien de praktijkvariatie, is het doel van deze module om te onderzoeken of een bepaald middel wetenschappelijk aantoonbaar de voorkeur heeft en op welke wijze het middel gebruikt dient te worden.
Concluderend is het doel van deze module om te beschrijven wat de plaats is van huiddesinfectie voorafgaand aan een bloedafname en een injectie (intramusculair, subcutaan, intradermaal) en welk huiddesinfectiemiddel hierin de voorkeur heeft op het voorkómen van een (lokale/systemische) infectie bij de patiënt en op het reduceren van het risico op contaminatie van het bloedmonster (in het geval van bloedafname).
Sub-question 1 Added value of skin disinfection prior to venous blood sampling
For this question, a systematic review of the literature was performed to answer the following question:
What is the added value of skin disinfection prior to venous blood sampling (exclusion: blood sampling for culture/identifying microbes, blood transfusion or insertion catheter)?
P: Patients eligible for venous blood sampling (exclusion: blood transfusion or insertion catheter)
I: Skin disinfection prior to venous blood sampling
C: No skin disinfection prior to venous blood sampling
O: Infection, blood culture contamination
Sub-question 2 Added value of skin disinfection prior to injection
For this question, a systematic review of the literature was performed to answer the following question:
What is the added value of skin disinfection prior to intramuscular, subcutaneous, or intradermal injection on the prevention of post-injection infection?
P : Patients receiving injection (intramuscular, subcutaneous, intradermal)
I : Skin disinfection prior to injection (intramuscular, subcutaneous, intradermal) of a medicinal substance
C : No skin disinfection prior to injection (intramuscular, subcutaneous, intradermal) of a medicinal substance (e.g., vaccination, insulin injection)
O: Local or systemic infection
Sub-question 3 Antiseptic skin preparation agents
For this question, a systematic review of the literature was performed to answer the following question:
Which skin antiseptic agent is the safest in use and most effective to prevent infection and contamination prior to blood sampling for diagnostic and screening purposes and prior to injections (intramuscular, subcutaneous, and intradermal)?
P: Skin disinfection before venous blood sampling and injection (intramuscular, subcutaneous, intradermal) of a medicinal substance
I: Antiseptic skin preparation agents, (alcohol, isopropyl, ethanol, povidone-iodine, chlorhexidine)
C: Antiseptic skin preparation agents, (alcohol, isopropyl, ethanol, povidone-iodine, chlorhexidine)
O: Infection, side effect, blood culture contamination regarding venous blood sampling
Relevant outcome measures
- For sub-question 1, the guideline development group considered infection and blood culture contamination as critical outcome measures for decision making.
- For sub-question 2, the guideline development group considered infection as a critical outcome measure for decision making.
- For sub-question 3, the guideline development group considered infection, side effects, and blood culture contamination as critical outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. The working group defined a 25% relative difference for dichotomous outcomes (RR < 0.8 or > 1.25), and a 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (methods)
Sub-question 1: Added value of skin disinfection prior to venous blood sampling
The databases Embase (via embase.com), Medline (via OVID) and Cinahl were searched with relevant search terms until 20 December 2022. The detailed search strategy is available on request (via info@sri-richtlijnen.nl). The systematic literature search resulted in 132 hits. Studies were selected based on the following criteria:
- Systematic review (detailed search strategy, risk of bias assessment, and results of individual comparative studies available), randomised control trial, observational comparative study, and guideline;
- Research question includes all elements of the PICO;
- Full text available;
- Full text written in English or Dutch.
Based on title and abstract screening, thirteen studies were selected. After reading the full text, all studies were excluded (see Literatuursamenvatting Module 1.2 Bloedafname en injecties under the tab Onderbouwing). Important study characteristics and results are summarised in the Evidence table. The assessment of the risk of bias is summarised in the Risk of bias table.
Sub-question 2: Added value of skin disinfection prior to injection.
The databases Embase (via embase.com), Medline (via OVID) and Cinahl were searched with relevant search terms until 20 December 2022. The detailed search strategy is available on request (via info@sri-richtlijnen.nl). The systematic literature search resulted in 760 hits. Studies were selected based on the following criteria:
- Systematic review (detailed search strategy, risk of bias assessment, and results of individual comparative studies available), randomised control trial, observational comparative study, and guideline;
- Research question includes all elements of the PICO;
- Full text available;
- Full text written in English or Dutch.
In total, eighteen studies were initially selected based on title and abstract screening. After reading the full text, fifteen studies were excluded (see Table of excluded studies), and three studies were included. Important study characteristics and results are summarised in the evidence table. The assessment of the risk of bias is summarised in the Risk of bias table.
Sub-question 3: Antiseptic skin preparation agents.
The databases Medline (via OVID), Embase (via embase.com), and Cinahl were searched with relevant search terms until 22 December 2022. The detailed search strategy is available on request (via info@sri-richtlijnen.nl). The systematic literature search resulted in 954 hits. Studies were selected based on the following criteria:
- Systematic review (detailed search strategy, risk of bias assessment, and results of individual comparative studies available), randomised control trial or observational comparative study;
- Research question includes all elements of the PICO;
- Full text available;
- Full text written in English or Dutch.
First, systematic reviews (SRs) and randomised control trials (RCTs) were selected if they complied with the PICO. Based on title and abstract screening, 49 studies were selected. After reading the full text, 45 studies were excluded (see Table of excluded studies) and one SR and three RCTs were included. These four studies compared antiseptic agents prior to venous blood sampling and reported blood culture contamination as an outcome. The SR included eight studies, of which four did not meet our selection criteria. Therefore, a total of seven studies are included.
None of the SRs and RCTs reported infection or side effects as an outcome following venous blood sampling or intramuscular, subcutaneous, intradermal injection. Therefore, observational studies were selected if they compared antiseptic agents prior to venous blood sampling or injection (intramuscular, subcutaneous, or intradermal) and reported infection and/or side effects as outcomes. Based on title and abstract screening, twelve studies were selected. After reading the full text, all observational studies were excluded (see table of excluded studies). Important study characteristics and results are summarised in the evidence table. The assessment of the risk of bias is summarised in the Risk of bias table.
Description of studies
Sub-question 1 Skin disinfection venous blood sampling
It was not possible to provide a summary of literature because of the absence of relevant studies.
Sub-question 2 Skin disinfection injection
Intramuscular and subcutaneous injections
Wong (2019) conducted a randomized controlled trial determining the effectiveness of alcohol in reducing local skin reactions and infection post-vaccination. The study was carried out in a Canadian pediatric clinic between May and November 2017. Four hundred and two children were assessed for eligibility from which 170 children were included. Two hundred and thirty-two children were excluded because they did not meet inclusion criteria, refused to participate, or were not approached. The intervention group received an alcohol swab at the pre-defined injection site(s) prior to injection and the control group received an alcohol swab adjacent to the pre-defined injection site. All participants received between one and four vaccinations by a research assistant. Afterwards, parents assessed the injection sites and recorded local skin reactions (pain, redness, swelling, warmth, and spontaneous drainage of pus from the injection site) using a paper diary for two weeks (day 0-14). Parents were approached by telephone 24 hours (Day 1), 5 days (Day 5), and 14 days (Day 14) post-vaccination and questioned whether local skin reactions were present. Infection was considered for local skin reactions present on or after day 5 post-vaccination and parents were asked to visit the pediatrician with their child. In case cellulitis or an infectious abscess was suspected in accordance with the Brighton Collaboration criteria, parents were asked informed consent to take aspiration of the injection site to aid in the diagnosis.
Intramuscular, subcutaneous, and intradermal injections
Khawaja (2013) conducted a quasi-experimental study assessing the need for use of skin preparation using a 70% isopropyl alcohol swab prior to intramuscular, subcutaneous, or intradermal injection. Patients with skin disease and co-morbidity (e.g., immunosuppressed or heart valve disease) were excluded. The study was carried out in a hospital in Saudi-Arabia between August 2012 – December 2012. Patients were allocated to the intervention group (skin preparation with alcohol swab) or to the control group (no skin preparation) prior to abovementioned three types of injection. In the intervention group, the site of injection was disinfected with the 70% isopropyl alcohol swab for 30 seconds and allowed to dry for 30 seconds before injection took place. The injection site was assessed for erythema, pain, swelling, fever, and abscess formation on day 2-3. Patients positive for one or more of these signs or symptoms, were asked to monitor the injection site and report the redness, tenderness, or another abnormal signs. This group was followed over a period of three weeks on a weekly basis by a family physician (blind to swab status).
Subcutaneous injection
Koivisto (1978) conducted a cross-over study determining whether omission of skin preparation with 70% isopropyl alcohol prior to insulin injection resulted in infection at the injection site. The study was carried out by the department of internal medicine of the Yale University School of Medicine in the USA. During a 3 – 5-month period, insulin-dependent diabetic patients were asked to omit skin preparation before insulin injection in each alternate week. Patients were asked to monitor the injection site and record the following signs: redness, tenderness, or any another abnormal sign. The injection sites were inspected by the researchers every two weeks. In total, 13 patients were involved who administered more than 1700 injections without skin preparation.
Sub-question 3 Skin antiseptic agents venous blood sampling and injection
Infection
No studies were found.
Side effects
No studies were found.
Blood culture contamination
Martinez (2017) carried out a multicenter randomized controlled trial to evaluate the effectiveness of isopropyl alcohol (IPA) and chlorhexidine gluconate in isopropyl alcohol (CHG) on blood culture contamination rates. The study was conducted at two teaching hospitals in Mexico and included patients aged sixteen years or older suspected of having a bloodstream infection (BSI) who were admitted to the emergency room, internal medicine ward, or intensive care unit. A set of blood cultures were taken, which consisted of at least two cultures from different sites and at least one had to be from a peripheral vein. Blood culture samples were collected by trained nurses from a catheter care unit. First, all patients received skin preparation with isopropyl alcohol, with repeated back-and-forth strokes for 30 seconds (s). Then, either IPA or CHG was applied by an applicator. Blood culture samples were incubated for up to 5 days at 35oC ± 1oC in a BacT/Alert 3D system. The microbiologist determined if the blood culture sample was true positive, contaminated, or negative and performed identification and susceptibility tests for the isolated microorganisms. A blood culture sample was considered contaminated if one of two blood culture samples was exhibited the growth of one of the following microorganisms: coagulase-negative Staphylococcus, Corynebacterium spp., Bacillus spp., Propionibacterium spp., Micrococcus spp., or ⍺-hemolytic viridans group streptococci, or when the same organism was not isolated from another potentially infected site. A total of 1,102 sets of blood culture samples were obtained. Information on the concentration of isopropyl alcohol used prior to the application of the skin antiseptic agents that were compared to each another was not reported.
Story-Roller (2016) conducted a randomized cross-over trial to assess the effectiveness of CHG and iodine tincture (IT) on blood culture contamination rates. The study was conducted among patients suspected of having a BSI, and therefore, a set of blood cultures (one aerobic and one anaerobic) were taken per patients. Eight nursing units in an American hospital participated in the study from July 2014 and June 2015. Blood culture samples were drawn by trained nurses utilized aseptic technique. After a 3-month period, the units switched to the another antiseptic agent without a wash-out period. This alternating skin disinfection method was carried out on a quarterly basis for a one-year period. First, all patients received skin preparation with IPA for 30 s, followed by the application of either IT or CHG. The IT was administered in concentric circles moving away from the venepuncture site to an approximately 5-cm diameter, and allowed to dry for 30 s. The CHG was administered in a back-and forth motion over the venepuncture site to cover an area approximately 5-cm diameter, and allowed to dry for 30 s. The blood culture samples were incubated at 35oC using Bactec FX system for five days. Positive cultures were further subcultured and processed using standard laboratory techniques. A blood culture sample was considered contaminated if only in one of two blood culture sample exhibited the grow of common skin organisms, including coagulase-negative Staphylococcus, viridans group streptococci, Bacillus spp., Neisseria spp. (another than Neisseria meningitidis or Neisseria gonorrhoeae), Micrococcus spp., or aerobic gram-positive rods. The investigator compared the blood culture samples considered as contaminated with the clinical presentations by reviewing the electronic medical record of these patients to confirmed that they were true false positive. A total of 6,095 blood culture sample sets were obtained. Information on the concentration of isopropyl alcohol used prior to the application of the skin antiseptic agents that were compared to each another was not reported.
Washer (2013) conducted a randomized crossover trial to evaluate the effectiveness of 10% povidone iodine aqueous solution (PI), IT, and CHG on blood culture contamination rates. The study was carried out among adult patients for whom clinicians had ordered blood culture samples at three medical-surgical units in an American University hospital from May 2008 through September 2009. All blood culture samples were obtained by trained phlebotomists. Prior to the application of PI or IT, the skin was first scrubbed with an alcohol prep pad for 30 s. Then either PI or IT was applied in concentric circles away from the venepuncture site, to cover an area 4 - 5 cm in diameter. PI was allowed to dry for 60 s, and IT was allowed to dry for 30 s before venepuncture. In case of iodine allergy, skin antisepsis with alcohol only was used. The CHG was applied directly onto the skin without prior disinfection with an alcohol prep pad. CHG was applied in a back-and-forth motion over the venepuncture site to cover an area 4 - 5 cm in diameter. Then CHG was allowed to dry for 30 s before venepuncture. After skin disinfection, the venepuncture site was not palpated (again). After a 5-month period, the units switched to the another antiseptic agent with a 1-month washout period. Aerobic and anaerobic bottles were incubated at 37oC for 5 days (or longer if requested) using BacTAlert system. Positive cultures were further subcultured and processed using standard laboratory techniques. Two infectious diseases physicians examined the positive cultures and classified them as either true positive or contaminated. A blood culture sample was considered contaminated if only in one of two blood culture sample exhibited growth of common skin organisms, including aerobic gram-positive rods, Lactobacillus spp. Propionibacterium acnes (currently Cutibacterium acnes), Micrococcus spp., Bacillus spp. (not B. anthracis or B. cereus), coagulase-negative Staphylococcus, Neisseria spp. (another than Neisseria meningitidis or Neisseria gonorrhoeae), or 𝜸-hemolytic streptococci (not Enterococcus spp.). A total of 12,904 blood culture samples were collected from 3,879 patients. Hundred eighteen blood draws were audited regarding adherence on aseptic technique. Information on concentration of the isopropyl alcohol pad and drying time prior to the use of PI and IT was not reported.
Suwanpimolkul (2008) carried out a randomized controlled trial to evaluate the effectiveness of CHG and PI on blood culture contamination rates. The study was conducted among adult patients who were suspected of having bacteremia admitted to medical wards, intensive care units, and emergency room at a hospital in Thailand from August to October 2006. Blood culture samples were drawn by students, residents, or nurses. Both skin antiseptic agents were applying twice according to the institutional protocol and allowed to dry for approximately 1 min after the application. The septa of the culture bottles were wiped with a PI-pad before inoculation. The needle switch approach was not used. The 5-ml sample was inoculated into an aerobic bottle of blood culture broth, and then incubated at 37OC for 7 days. Positive cultures were further subcultured and processed using standard laboratory techniques. A blood culture sample was considered contaminated if: (a) only in one of two blood culture sample exhibited growth of the following common skin organisms without isolation of the same organism from another potentially infected site: a common skin flora including coagulase-negative Staphylococcus, Corynebacterium spp., Micrococcus spp., Bacillus spp., or Propionibacterium spp., and (b) a common skin flora was isolated in a patient with incompatible clinical features, no attributable risks, and improvement without specific treatment for that organism. A total of 2146 blood culture samples were collected from 1,730 patients. The study did not report whether personnel who collected the blood samples were trained in technique.
Calfee (2002) conducted a randomized, crossover trial to evaluate the effectiveness of PI, IPA, IT, or povidone-iodine in 70% ethyl alcohol (Persist) on blood culture contamination. The study was carried out among patients admitted the emergency room (ER) and on all inpatient care units, excluding the neonatal intensive care unit, at an American hospital for 1 year in 1999 and 2000. Blood culture samples were drawn by trained physicians, nurses, and phlebotomists. The four skin antiseptic agents were packaged in envelopes. Each envelope contained three swabsticks soaked in the respective antiseptic agent. The venepuncture site was disinfected by using the three swabsticks one after another, beginning in the center and continuing in an outward direction using circular strokes for an area 5 – 7 cm in diameter successively and allowed to dry for at least one min. Culture bottles (aerobic and anaerobic) were inoculated by using the same needle used to perform venepuncture. After a 3-month period, the units switched to the another antiseptic agent with a 2-week washout period. This alternating skin disinfection method was carried out until the study groups used all four antiseptic agents. Blood specimens were incubated for seven days unless the ordering physician requested longer incubation. Standard aerobic and anaerobic bottles were processed by the microbiology lab according to standard protocol using BacTAlert. Positive cultures were further subcultured and processed using standard laboratory techniques. The physician investigator reviewed the positive cultures and classified them as true positive or as contaminated. A culture was considered contaminated if a common skin organism was isolated from only one of two blood samples obtained from different sites, i.e., coagulase-negative Staphylococcus, Micrococcus spp., Bacillus spp., Propionibacterium acnes (currently Cutibacterium acnes), viridans streptococci, or Corynebacterium spp.. In total of 12,806 blood culture samples were collected during the study period. The study did not report on the number of patients from whom blood cultures were collected.
Mimoz (1999) conducted a randomized controlled trial to evaluate the effectiveness of PI and CHG on blood culture contamination rates. The study was carried out in three adult intensive care units at a French teaching hospital between 1 December 1997 and 24 April 1998. Blood culture samples were drawn by nurses. Both antiseptic agents were applied vigorously and allowed to dry for 15 to 30 s after application. The blood samples were simultaneously inoculated into aerobic and anaerobic vials of blood culture media. The cultures were incubated at 37OC for five days, and standard methods and criteria were used to isolate organisms and their susceptibilities. Contaminant isolates were defined as isolates of several organisms obtained from one set of blood cultures and identical organism that was not obtained from another potentially infected site five days before or five days after blood culture collection. Several organisms considered as a contaminant were coagulase-negative Staphylococci, Propionibacterium acnes (currently Cutibacterium acnes), Streptococcus spp. (viridans group), Corynebacterium spp. (excluding group JK), Micrococcus spp., or Bacillus spp.. During the study, a total of 2041 blood culture samples were collected from 403 patients. The study did not report whether nurses who collected the blood samples were trained in technique.
Little (1999) conducted a randomized controlled trial to evaluate the effectiveness of PI and IT on blood culture contamination rates. The study was carried out in adult inpatients units at an American tertiary care teaching hospital between December 1, 1995, and July 31, 1991. Blood culture samples were drawn by trained experienced phlebotomists. Patients in whom the skin was disinfected with PI were first treated with IPA gauze pad for one min. Patients in whom the skin was disinfected with IT were first scrubbed with a 70% IPA applicator for 1 min before applying the iodine tincture. Both antiseptic agents were allowed to dry for 2 min prior to venepuncture. A needle change methodology was not utilized. Blood culture samples were processed using BACTEC 9240. Blood culture sets included one bottle each of aerobic/F and aerobic/F Plus (a resin-containing bottle) BACTEC soybean-casein digest media. All culture sets were incubated until growth was detected, or for a total of seven days. A positive culture was considered contaminated if it yielded growth of Corynebacterium spp., Propionibacterium spp., Clostridium spp., Micrococcus spp. or Bacillus spp., coagulase-negative Staphylococci, or Acinetobacter baumannii in one or both bottles without isolation of the same organism from another blood culture sample of another site culture. For comparison, also data were included on the total blood culture contamination rate (not just skin flora) using the criteria of MacGregror and Beaty. In the study, a total of 3,851 blood culture samples were collected from 1,503 patients. The concentration of the IPA gauze pad used prior to PI was not reported as well as information was lacking on difference in contamination rates between ER and ICU.
Results
Sub-question 1 Skin disinfection venous blood sampling
Not applicable
Sub-question 2 Skin disinfection injection
Local or systemic infection
Wong (2019) found no local or systemic infections among the participants both in the intervention group and control group. Each group consisted of 85 children. The participants in the intervention group received 142 vaccinations in total; 119 vaccinations administered intramuscularly and 23 vaccinations subcutaneously. Participants in the control group received 137 vaccinations in total; 118 administered intramuscularly and 19 vaccinations subcutaneously. There was a difference in loss to follow-up between both groups due to missing telephone survey or diary data, 14 and 18 patients, respectively. Reasons for this were not reported. Seven participants had one or two local skin reactions on Day 5 and were invited to return to the clinic. Only one patient returned to the pediatrician from which the diagnosis was injection site swelling. No aspiration of the injection site was done.
The two observational studies, (Khawaja, 2013; Koivisto, 1978) found no local or systemic infection among the participants both in the intervention and control group.
Sub-question 3 Skin antiseptic agents venous blood sampling and injection
Infection
No studies were found.
Side effects
No studies were found.
Blood culture contamination
- Comparison of alcoholic products versus non-alcohol products in studies using a 1-step method of skin disinfection
Three studies compared alcoholic products with non-alcohol products using a 1-step method of skin disinfection. Mimoz (1999) found 34 (34/1022) contaminated blood cultures in the PI group compared to 14 (14/1019) in the CHG group. Suwanpimolkul (2008) found 34 (34/1068) contaminated blood cultures in the CHG group compared to 74 (74/1078) in the PI group. The pooled RR was 0.45 [95%CI: 0.32 – 0.63] in favor of the use of an alcoholic product. This is a clinically relevant difference.
Calfee (2002) found 99 (99/3,378) contaminated blood cultures in the PI group compared to 81 (81/3,138) in the IT group, 78 (78/3,125) in the IPA group, and 75 (75/3,051) in the Persist group. The RR was 0.86 [95%CI: 0.68 – 1.08] in favor of the use of an alcoholic product. This is not a clinically relevant difference. - Comparison of alcoholic products in the first and second step of skin disinfection versus only alcoholic product in the first disinfection step (studies using a 2-steps method of skin disinfection)
Two studies compared alcoholic products used in the first and second step of a 2-step method of skin disinfection versus only an alcoholic product in the first disinfection step. Washer (2013) found 25 (25/4,286) contaminated blood cultures in the IPA/PI group compared to 32 (32/4,230) in the IPA/IT group. The RR was 1.30 [95%CI: 0.77 – 2.18] in favor of the use of only an alcoholic product in the first disinfection step. This is a clinically relevant difference. Little (1999) found 74 (74/1947) contaminated blood cultures in the IPA/PI compared to 46 (46/1904) in the IPA/IT group. The RR was 0.64 [95%CI: 0.44 – 0.91] in favor of the use of alcoholic products used in the first and second disinfection step. This is a clinically relevant difference. - Comparison of chlorhexidine gluconate versus another alcoholic products in the second disinfection step (studies using a 2-steps method of skin disinfection; first step involving skin disinfection using an alcoholic product in both groups)
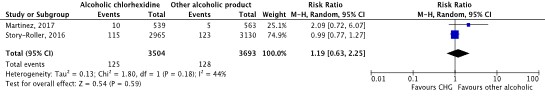
Two studies compared CHG with another alcoholic products in the second disinfection step using a 2-steps method of skin disinfection. In both studies an alcoholic product was used in the first disinfection step. Martinez (2017) found a blood contamination rate of 0.9% (5/563) in patients where the skin of patients was first disinfected with IPA, followed by a 30 s drying time before being disinfected again with alcohol. Patients from whom the skin was first disinfected with IPA, followed by a 30 s drying time before being disinfected with CHG, the blood contamination rate was 1.7% (10/539). Story-Roller (2016) found a blood contamination rate of 3.93% (123/3130) where the skin of patients was first disinfected with IPA, followed by a 30 s drying time before being disinfected with IT. Patients from whom the skin was first disinfected with IPA, followed by a 30 s time before being disinfected with CHG, the blood contamination rate was 3.88% (115/2965). We calculated a pooled risk ratio (RR) for the two studies. The pooled RR was 1.19 [95%CI: 0.63 – 2.25] in favor of the use of another alcoholic product, with moderate heterogeneity (I2 = 44%). This is not a clinically relevant difference.
Level of evidence of the literature
Sub-question 1 Skin disinfection venous blood sampling
Not applicable
Sub-question 2 Skin disinfection injection
It was not possible to grade the evidence of skin disinfection prior to intramuscular, subcutaneous, or intradermal injection on the occurrence of local or systemic infections. The absence of events in the studies could be attributed to the low number of included patients (power) or the follow-up duration (too short).
Sub-question 3 Skin antiseptic agents venous blood sampling and injection
Infection
The level of evidence could not be assessed for the outcome measure infection, because no studies were found.
Side effects
The level of evidence could not be assessed for the outcome measure side effects, because no studies were found.
Blood culture contamination
The level of evidence was assessed for the outcome measure blood culture contamination:
- Comparison of alcoholic products versus non-alcohol products in studies using a 1-step method of skin disinfection
The level of evidence regarding the outcome measure blood culture contamination started at high and was downgraded by two levels to low because of study limitations (-1; risk of bias: randomisation process unclear, no blinding of healthcare workers), imprecision (-1: confidence interval overlaps threshold for minimal clinically important difference). - Comparison of alcoholic products in the first and second step of skin disinfection versus only an alcoholic product in the first disinfection step (studies using a 2-steps method of skin disinfection)
The level of evidence regarding the outcome measure blood culture contamination started at high and was downgraded by three levels to very low because of study limitations (-1; risk of bias: no blinding of healthcare workers, another problems mentioned in table risk of bias), inconsistency (-1, results are contradictory), imprecision (-1: confidence interval overlaps threshold for minimal clinically important difference). - Comparison of chlorhexidine gluconate versus another alcoholic products in the second disinfection step (studies using a 2-steps method of skin disinfection; first step involving skin disinfection using an alcoholic product in both groups)
The level of evidence regarding the outcome measure blood culture contamination started at high and was downgraded by 3 levels to very low because of study limitations (-1; risk of bias: randomisation process unclear, no blinding of healthcare workers and outcome assessors, another problems), and imprecision (-2: confidence interval overlaps both thresholds for minimal clinically important difference).
Sub-question 1 Skin disinfection venous blood sampling
No conclusions could be drawn because of the absence of relevant studies.
|
No GRADE (Grading Recommendations Assessment, Development and Evaluation ) |
No evidence was found regarding the added value of skin disinfection prior to venous blood sampling. |
|---|
Sub-question 2 Skin disinfection injection
It was not possible to grade the evidence of skin disinfection prior to intramuscular, subcutaneous, or intradermal injection on the occurrence of local or systemic infections. The absence of events in the studies could be attributed to the low number of included patients (power) or the follow-up duration (too short).
|
No GRADE |
It was not possible to draw a conclusion nor to grade the evidence of skin disinfection prior to intramuscular, subcutaneous, or intradermal injection on the occurrence of local or systemic infections. The absence of events in the studies could be attributed to the low number of included patients (power) or the follow-up duration (too short). Source: Wong, 2019 |
|---|
Sub-question 3 Skin antiseptic agents venous blood sampling and injection
Infection
|
No GRADE |
No evidence was found regarding what skin antiseptic agent is preferred to use prior to venous blood sampling for diagnostic and screening purposes or injections (intramuscular, subcutaneous and intradermal) to prevent infection in the patient. Source: - |
|---|
Side effects
|
No GRADE |
No evidence was found regarding what skin antiseptic agent is preferred to use safely prior to venous blood sampling for diagnostic and screening purposes or injections (intramuscular, subcutaneous, and intradermal). Source: - |
|---|
Blood culture contamination
- Comparison of alcoholic products versus non-alcohol products in studies using a 1-step method of skin disinfection
|
LOW GRADE |
The evidence suggests that alcoholic products used as skin antiseptic agent reduces blood culture contamination when compared with non-alcohol products in a 1-step method of skin disinfection prior to venous blood sampling for diagnostic purposes Source: Suwanpimolkul (2008), Calfee (2002), Mimoz (1999) |
|---|
- Comparison of alcoholic products in the first and second step of skin disinfection versus only alcoholic product in the first disinfection step (studies using a 2-steps method of skin disinfection)
|
Very LOW GRADE |
The evidence is very uncertain about the effect of using alcoholic products in both steps of a 2-step method of skin disinfection on blood culture contamination when compared with using only alcohol products in the first step of this method prior to venous blood sampling for diagnostic purposes Source: Washer (2013), Little (1999) |
|---|
- Comparison of chlorhexidine gluconate versus another alcoholic products in the second disinfection step (studies using a 2-steps method of skin disinfection; first step involving skin disinfection using an alcoholic product in both groups).
|
Very LOW GRADE |
The evidence is very uncertain about the effect of using chlorhexidine gluconate in the second disinfection step of a 2-step method of skin disinfection on blood culture contamination when compared with another alcoholic products used in the second disinfection step of this method prior to venous blood sampling for diagnostic purposes Source: Martinez (2017), Story-Roller (2016) |
|---|
WHO Guidelines on Drawing Blood: Best Practices in Phlebotomy. Geneva: World Health Organization; 2010. PMID: 23741774.
Khawaja, R. A. and Sikanda, R. and Qureshi, R. and Jareno, R. J. M. Routine skin preparation with 70% isopropyl alcohol swab: Is it necessary before an injection? Quasi study. Journal of the Liaquat University of Medical and Health Sciences. 2013; 12 (2) :109-114.
Koivisto VA, Felig P. Is skin preparation necessary before insulin injection? Lancet. 1978 May 20;1(8073):1072-5. doi: 10.1016/s0140-6736(78)90916-9. PMID: 77369.
Wong H, Moss C, Moss SM, Shah V, Halperin SA, Ito S, Mithal P, Qu A, Taddio A. Effect of alcohol skin cleansing on vaccination-associated infections and local skin reactions: a randomized controlled trial. Hum Vaccin Immunother. 2019;15(4):995-1002. doi: 10.1080/21645515.2018.1553474. Epub 2019 Jan 16. PMID: 30513266; PMCID: PMC6605859.
Bekijk de Evidence-tabellen:
Sub-question 1 Skin disinfection venous blood sampling
|
Reference |
Reason for exclusion |
|---|---|
|
Sutton CD, White SA, Edwards R, Lewis MH. A prospective controlled trial of the efficacy of isopropyl alcohol wipes before venesection in surgical patients. Ann R Coll Surg Engl. 1999 May;81(3):183-6. PMID: 10364951; PMCID: PMC2503183. |
Wrong population (venesection and intravenous cannulation) |
|
Magnette A, Chatelain M, Chatelain B, Ten Cate H, Mullier F. Pre-analytical issues in the haemostasis laboratory: guidance for the clinical laboratories. Thromb J. 2016 Dec 12;14:49. doi: 10.1186/s12959-016-0123-z. PMID: 27999475; PMCID: PMC5154122. |
Wrong intervention, wrong outcome, wrong study design |
|
Abdollahi F, Arbabisarjou A. Comparing the Effect of Disinfectant Solution of 2% Chlorhexidine Gluconate and 70% Alcohol on Prevention of Phlebitis. Der Pharmacia Lettre. 2016;8(6):129-134. |
Wrong population, wrong comparison |
|
Kirschner MH, Lang RA, Breuer B, Breuer M, Gronover CS, Zwingers T, Böttrich JG, Arndt A, Brauer U, Hintzpeter M, Burmeister MA, Fauteck JD. Transdermal resorption of an ethanol- and 2-propanol-containing skin disinfectant. Langenbecks Arch Surg. 2009 Jan;394(1):151-7. doi: 10.1007/s00423-007-0237-7. Epub 2007 Nov 8. PMID: 17989993. |
Wrong comparison, wrong outcome |
|
Story-Roller E, Weinstein MP. Chlorhexidine versus Tincture of Iodine for Reduction of Blood Culture Contamination Rates: a Prospective Randomized Crossover Study. J Clin Microbiol. 2016 Dec;54(12):3007-3009. doi: 10.1128/JCM.01457-16. Epub 2016 Oct 5. PMID: 27707940; PMCID: PMC5121392. |
Wrong population, wrong comparison |
|
Suwanpimolkul G, Pongkumpai M, Suankratay C. A randomized trial of 2% chlorhexidine tincture compared with 10% aqueous povidone-iodine for venipuncture site disinfection: Effects on blood culture contamination rates. J Infect. 2008 May;56(5):354-9. doi: 10.1016/j.jinf.2008.03.001. Epub 2008 Apr 14. PMID: 18407355. |
Wrong comparison |
|
Washer LL, Chenoweth C, Kim HW, Rogers MA, Malani AN, Riddell J 4th, Kuhn L, Noeyack B Jr, Neusius H, Newton DW, Saint S, Flanders SA. Blood culture contamination: a randomized trial evaluating the comparative effectiveness of 3 skin antiseptic interventions. Infect Control Hosp Epidemiol. 2013 Jan;34(1):15-21. doi: 10.1086/668777. Epub 2012 Nov 26. PMID: 23221187. |
Wrong population, wrong intervention |
|
Bolerázska B, Birková A, Čižmárová B. Recommendations for safe collection of venous blood by a closed collection system. Vnitr Lek. 2021 Winter;67(E-7):8-12. English. PMID: 35459351. |
Wrong language (Czech) |
|
Lima-Oliveira G, Volanski W, Lippi G, Picheth G, Guidi GC. Pre-analytical phase management: a review of the procedures from patient preparation to laboratory analysis. Scand J Clin Lab Invest. 2017 May;77(3):153-163. doi: 10.1080/00365513.2017.1295317. Epub 2017 Mar 7. PMID: 28266238. |
Wrong study design, narrative review of procedures from patient |
|
Choudhuri M, McQueen R, Inoue S, Gordon RC. Efficiency of skin sterilization for a venipuncture with the use of commercially available alcohol or iodine pads. Am J Infect Control. 1990 Apr;18(2):82-5. doi: 10.1016/0196-6553(90)90086-8. PMID: 2337259. |
Wrong comparison, wrong outcome |
|
Ergin E, Zaybak A. Effects of Different Methods Used to Take Blood Samples on Blood Glucose Measurements. Clin Nurs Res. 2022 Jan;31(1):29-38. doi: 10.1177/10547738211024782. Epub 2021 Jul 5. PMID: 34218680. |
Wrong comparison, wrong outcome |
|
Franklin L. Skin cleansing and infection control in peripheral venepuncture and cannulation. Nurs Stand. 1999 Oct 13-19;14(4):49-50. doi: 10.7748/ns1999.10.14.4.49.c2695. PMID: 10855178. |
Wrong study design, narrative review |
|
Cornes MP, Church S, van Dongen-Lases E, Grankvist K, Guimarães JT, Ibarz M, Kovalevskaya S, Kristensen GB, Lippi G, Nybo M, Sprongl L, Sumarac Z, Simundic AM; Working Group for Preanalytical Phase (WG-PRE) and European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). The role of European Federation of Clinical Chemistry and Laboratory Medicine Working Group for Preanalytical Phase in standardization and harmonization of the preanalytical phase in Europe. Ann Clin Biochem. 2016 Sep;53(Pt 5):539-47. doi: 10.1177/0004563216643969. Epub 2016 May 1. PMID: 27141012. |
Wrong study design, overview of guidelines regarding preanalytical policies and practices |
Sub-question 2 Skin disinfection injection
|
Reference |
Reason for exclusion |
|---|---|
|
Lieffers MA, Mokkink HG. Desinfecteren van de huid vóór injecties niet van invloed op het ontstaan van infecties; een literatuurstudie [Disinfection of the skin prior to injections does not influence the incidence of infections; a literature study]. Ned Tijdschr Geneeskd. 2002 Apr 20;146(16):765-7. Dutch. PMID: 11998354. |
Wrong study design: does not describe detailed search strategy and does not include risk of bias assessment |
|
Little K. Skin preparation for intramuscular injections. Nurs Times. 2000 Jan;96 (46):6-8. |
Wrong study design: narrative review |
|
Dann TC. Routine skin preparation before injection - is it necessary?. Nurs Times. 1966;62(0):1121-1121. |
Wrong study design: intervention was no skin preparation, no comparator |
|
Ferreira A, Andrade D, Rigotti MA, Guerra OG. Antisepsis in administering injections: need or ritual? Revista Enfermagem UERJ. 2009;17(1):130-133. |
Full text is not available |
|
Gittens C, Bunnell T. Skin disinfection and its efficacy before administering injections. Nursing Standard, 2009;23(39):42-44. |
Wrong study design: narrative review |
|
Lewis MJ. Skin preparation before injection. Nurs Times. 1975 May 15;71(20):786-7. PMID: 1134951. |
Wrong study design: narrative review |
|
Pereira A, Vieira A, Silva E, Menino V, Sousa MR, Carvalho JC. Use of antiseptics on skin preparation in intramuscular therapy management: what needs [sic]. Nursing: Revista de Formacao Continua em Enfermagem, 2010;22(258):35-38. |
Full text is not available |
|
Antiseptic effects at injection sites |
Wrong comparison: disinfection agents, wrong outcome: bacteria reduction rate |
|
Pratt RJ, Hoffman PN, Robb FF. The need for skin preparation prior to injection: point - counterpoint. British Journal of Infection Control. 2005;6(4):18-20. doi: 10.1177/14690446050060040801. |
Wrong study design: point - counterpoint |
|
Shepherd A. Contamination of injection sites by landmark palpation after skin antisepsis. J Hosp Infect. 2009 Jan;71(1):97-8. doi: 10.1016/j.jhin.2008.09.004. Epub 2008 Nov 14. PMID: 19013673. |
Wrong injection site: intra-articular injection |
|
Dandoy CE, Ardura MI, Papanicolaou GA, Auletta JJ. Bacterial bloodstream infections in the allogeneic hematopoietic cell transplant patient: new considerations for a persistent nemesis. Bone Marrow Transplant. 2017 Aug;52(8):1091-1106. doi: 10.1038/bmt.2017.14. Epub 2017 Mar 27. PMID: 28346417. |
Study among allogeneic hematopoietic cell transplantation patients with another focus (e.g., skin decontamination undergoing cardiac surgery) |
|
Dooley P, Martin R. Corticosteroid injections and arthrocentesis. Can Fam Physician. 2002 Feb;48:285-92. PMID: 11889888; PMCID: PMC2213980. |
Wrong injection site: intra-articular and soft tissue corticosteroid injection |
|
Ramirez-Arcos S, Goldman M. Skin disinfection methods: prospective evaluation and postimplementation results. Transfusion. 2010 Jan;50(1):59-64. doi: 10.1111/j.1537-2995.2009.02434.x. Epub 2009 Oct 10. PMID: 19821950. |
Wrong population: transfusion, wrong intervention: two agents and one-step vs two-step were compared |
|
Fleming DR, Jacober SJ, Vandenberg MA, Fitzgerald JT, Grunberger G. The safety of injecting insulin through clothing. Diabetes Care. 1997 Mar;20(3):244-7. doi: 10.2337/diacare.20.3.244. PMID: 9051365. |
Wrong comparison: skin preparation vs injection technique through clothing |
|
Qamar, M. and Gillani, S. W. and Sulaiman, S. A. S. The skin preparation knowledge, attitudes and practices among the healthcare professionals in compliance with the world health organization (WHO) guidelines. Journal of Clinical and Diagnostic Research. 2012; 6 (6) :1041-1046. |
Study on knowledge, attitudes, and practices among the healthcare professionals in compliance with the world health organization (WHO) guidelines |
Sub-question 3 Skin antiseptic agents venous blood sampling and injection
Systematic reviews and randomised controlled trials
|
Reference |
Reason for exclusion |
|---|---|
|
American Society of Anesthesiologists Task Force on Central Venous Access; Rupp SM, Apfelbaum JL, Blitt C, Caplan RA, Connis RT, Domino KB, Fleisher LA, Grant S, Mark JB, Morray JP, Nickinovich DG, Tung A. Practice guidelines for central venous access: a report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2012 Mar;116(3):539-73. doi: 10.1097/ALN.0b013e31823c9569. PMID: 22307320. |
Wrong population, patients received central katheter |
|
Liu W, Duan Y, Chen M. Author's response to 'Are skin antiseptics for blood culture collection really equal? Commentary on Liu, W., et al., 2016 "Skin antiseptics in venous puncture site disinfection for preventing blood culture contamination: A Bayesian network meta-analysis of randomized controlled trials"'. Int J Nurs Stud. 2017 Oct;75:81-82. doi: 10.1016/j.ijnurstu.2017.07.012. Epub 2017 Jul 22. PMID: 28755587. |
Wrong studydesign, author's response |
|
Liu W, Duan Y, Cui W, Li L, Wang X, Dai H, You C, Chen M. Skin antiseptics in venous puncture site disinfection for preventing blood culture contamination: A Bayesian network meta-analysis of randomized controlled trials. Int J Nurs Stud. 2016 Jul;59:156-62. doi: 10.1016/j.ijnurstu.2016.04.004. Epub 2016 Apr 25. PMID: 27222460. |
Concerns of comparisons between unequal antiseptic agents in meta-analyse |
|
Maiwald M. Are skin antiseptics for blood culture collection really equal? Commentary on Liu, W., et al., 2016 "Skin antiseptics in venous puncture site disinfection for preventing blood culture contamination: A Bayesian network meta-analysis of randomized controlled trials". Int J Nurs Stud. 2017 Oct;75:91-92. doi: 10.1016/j.ijnurstu.2017.07.011. Epub 2017 Jul 21. PMID: 28759824. |
Wrong studydesign, comment |
|
Maiwald M, Chan ES. The forgotten role of alcohol: a systematic review and meta-analysis of the clinical effectiveness and perceived role of chlorhexidine in skin antisepsis. PLoS One. 2012;7(9):e44277. doi: 10.1371/journal.pone.0044277. Epub 2012 Sep 5. PMID: 22984485; PMCID: PMC3434203. |
Only studies included with comparisons with chlorhexidine antiseptic agents. Three out of four studies regarding blood culture contamination also included in meta-analyse Caldeira (2011), one missing study (Washer) included in our summary of literature. |
|
Calfee DP, Farr BM. Comparison of four antiseptic preparations for skin in the prevention of contamination of percutaneously drawn blood cultures: a randomized trial. J Clin Microbiol. 2002 May;40(5):1660-5. doi: 10.1128/JCM.40.5.1660-1665.2002. PMID: 11980938; PMCID: PMC130950. |
Included in SR + meta-analyse Caldeira, 2011 |
|
Koivisto VA, Felig P. Is skin preparation necessary before insulin injection? Lancet. 1978 May 20;1(8073):1072-5. doi: 10.1016/s0140-6736(78)90916-9. PMID: 77369. |
Wrong intervention, necessity skin preparation |
|
Little JR, Murray PR, Traynor PS, Spitznagel E. A randomized trial of povidone-iodine compared with iodine tincture for venipuncture site disinfection: effects on rates of blood culture contamination. Am J Med. 1999 Aug;107(2):119-25. doi: 10.1016/s0002-9343(99)00197-7. PMID: 10460041. |
Included in SR + meta-analyse Caldeira, 2011 |
|
Sachdev S, Sethuraman N, Gautam V, Pahwa D, Kalra A, Sharma RR, Marwaha N, Ray P. Evaluation of the Role of Novel Aprotic Dimethyl Sulfoxide in Cutaneous Antisepsis Protocols Prior to Blood Donor Phlebotomy with Isopropyl Alcohol, Povidone Iodine or Chlorhexidine. Indian J Hematol Blood Transfus. 2018 Jan;34(1):132-137. doi: 10.1007/s12288-017-0816-x. Epub 2017 Apr 20. PMID: 29398812; PMCID: PMC5786613. |
Wrong population, blood donors; wrong intervention, evaluation of the role of dimethyl sufloxide; wrong outcome, bacterial load of the disinfected skin |
|
Schifman RB, Pindur A. The effect of skin disinfection materials on reducing blood culture contamination. Am J Clin Pathol. 1993 May;99(5):536-8. doi: 10.1093/ajcp/99.5.536. PMID: 8493946. |
Wrong comparison, comparison between disinfection procedures |
|
Sutton CD, White SA, Edwards R, Lewis MH. A prospective controlled trial of the effectiveness of isopropyl alcohol wipes before venesection in surgical patients. Ann R Coll Surg Engl. 1999 May;81(3):183-6. PMID: 10364951; PMCID: PMC2503183. |
Wrong population, patients undergoing venesection and intravenous cannulation |
|
Suwanpimolkul G, Pongkumpai M, Suankratay C. A randomized trial of 2% chlorhexidine tincture compared with 10% aqueous povidone-iodine for venipuncture site disinfection: Effects on blood culture contamination rates. J Infect. 2008 May;56(5):354-9. doi: 10.1016/j.jinf.2008.03.001. Epub 2008 Apr 14. PMID: 18407355. |
Included in SR + meta-analyse Caldeira, 2011 |
|
Trautner BW, Clarridge JE, Darouiche RO. Skin antisepsis kits containing alcohol and chlorhexidine gluconate or tincture of iodine are associated with low rates of blood culture contamination. Infect Control Hosp Epidemiol. 2002 Jul;23(7):397-401. doi: 10.1086/502073. PMID: 12138980. |
Included in SR + meta-analyse Caldeira, 2011 |
|
Breimer L, Geijer H, Berggren L. Desinfektion av injektionsportar – 15 sekunders skrubbning rimligt - En systematisk översikt kring optimal tidsåtgång [Disinfection of injection ports - a systematic overview of optimal scrub-time]. Lakartidningen. 2018 Jun 15;115:E6AL. Swedish. PMID: 29917174. |
Wrong language, Swedish; wrong comparison, scrub-time |
|
Richardson D. Vascular Access Nursing Practice, Standards of Care, and Strategies to Prevent Infection: A Review of Skin Cleansing Agents and Dressing Materials (Part I of a 3-Part Series). Journal of the Association for Vascular Access. 2016;11(4):215-221. doi:10.2309/java.11-4-14. |
Wrong studydesign, practice, standards, and dressing materials |
|
Webster J, Bell-Syer SE, Foxlee R. Skin preparation with alcohol versus alcohol followed by any antiseptic for preventing bacteraemia or contamination of blood for transfusion. Cochrane Database Syst Rev. 2015 Feb 12;2015(2):CD007948. doi: 10.1002/14651858.CD007948.pub3. PMID: 25674776; PMCID: PMC7185566. |
Wrong population, blood donors; wrong comparison, one step vs two step method |
|
Casey A, Karpanen T, Nightingale P, Elliott T. An in vitro comparison of microbial ingress into 8 different needleless IV access devices. J Infus Nurs. 2015 Jan-Feb;38(1):18-25. doi: 10.1097/NAN.0000000000000082. PMID: 25545971. |
Wrong population, patients received infusion; wrong comparison, comparison between IV access devices |
|
Choudhuri M, McQueen R, Inoue S, Gordon RC. Efficiency of skin sterilization for a venipuncture with the use of commercially available alcohol or iodine pads. Am J Infect Control. 1990 Apr;18(2):82-5. doi: 10.1016/0196-6553(90)90086-8. PMID: 2337259. |
Wrong outcome, bacterial load of disinfected skin |
|
DePaola LG, Fried JI. Frequently asked questions. Access. 2008;22(10):11-13 |
Full-text not available |
|
Ergin E, Zaybak A. Effects of Different Methods Used to Take Blood Samples on Blood Glucose Measurements. Clin Nurs Res. 2022 Jan;31(1):29-38. doi: 10.1177/10547738211024782. Epub 2021 Jul 5. PMID: 34218680. |
Wrong comparison, different interventions with or without skin preparation with alcohol; wrong outcome: blood glucose measurents |
|
Ferreira A, Andrade D, Rigotti MA, Guerra OG. Antisepsis in administering injections: need or ritual?. Revista Enfermagem UERJ. 2009;17(1):130-133 |
Wrong studydesign, narrative review. Full-tekst no available |
|
Franklin L. Skin cleansing and infection control in peripheral venepuncture and cannulation. Nurs Stand. 1999 Oct 13-19;14(4):49-50. doi: 10.7748/ns1999.10.14.4.49.c2695. PMID: 10855178. |
Wrong studydesign, narrative review |
|
Lawrence JC. The use of iodine as an antiseptic agent. J Wound Care. 1998 Sep;7(8):421-5. doi: 10.12968/jowc.1998.7.8.421. PMID: 9832752. |
Wrong studydesign, narrative review of one antiseptic agent |
|
Salvagno GL, Danese E, Lima-Oliveira G, Guidi GC, Lippi G. Avoidance to wipe alcohol before venipuncture is not a source of spurious hemolysis. Biochem Med (Zagreb). 2013;23(2):201-5. doi: 10.11613/bm.2013.023. PMID: 23894865; PMCID: PMC3900069. |
Wrong studydesign, no comparison of antiseptic agents; wrong outcome, spurious hemolysis |
|
[The use of alcohol as a disinfectant of the puncture when measuring capillary glycemia. Does it change the value of glycemia?] |
Wrong language, Spanish |
|
Monstrey SJ, Lepelletier D, Simon A, Touati G, Vogt S, Favalli F. Evaluation of the antiseptic activity of 5% alcoholic povidone-iodine solution using four different modes of application: a randomized open-label study. J Hosp Infect. 2022 May;123:67-73. doi: 10.1016/j.jhin.2022.02.020. Epub 2022 Mar 7. PMID: 35271958. |
Wrong comparison, four modes of application of one antiseptic agent; wrong outcome, bacterial load of disinfected skin |
|
Meneu Montoliu V, Cerdà Alfonso V, Canós Molinos J, Castaño Linares C, Grifo Mañá B, Monasor Giménez R. El uso del alcohol como desinfectante para la punción en la medición de la glucemia capilar. Altera el valor de la glucemia? [The use of alcohol as a disinfectant of the puncture when measuring capillary glycemia. Does it change the value of glycemia?]. Aten Primaria. 1997 Oct 31;20(7):372-5. Spanish. PMID: 9432219. |
Wrong language, Spanish |
|
Ramirez-Arcos S, Goldman M. Skin disinfection methods: prospective evaluation and postimplementation results. Transfusion. 2010 Jan;50(1):59-64. doi: 10.1111/j.1537-2995.2009.02434.x. Epub 2009 Oct 10. PMID: 19821950. |
Wrong outcome, bacterial load of disinfected skin |
|
Ruschman KL, Fulton JS. Effectiveness of disinfectant techniques on intravenous tubing latex injection ports. J Intraven Nurs. 1993 Sep-Oct;16(5):304-8. PMID: 8229434. |
Wrong population, patients with intravenous catheter; wrong comparison, different disinfectant techniques on latex injection ports |
|
Shavit I, Hadash A, Knaani-Levinz H, Shachor-Meyouhas Y, Kassis I. Lidocaine-based topical anesthetic with disinfectant (LidoDin) versus EMLA for venipuncture: a randomized controlled trial. Clin J Pain. 2009 Oct;25(8):711-4. doi: 10.1097/AJP.0b013e3181a689ec. PMID: 19920722. |
Wrong intervention, testing new topical anestheticum containing a disinfection ingredient compared to proven EMLA cream |
|
Wistrand C, Nilsson U. Effects and experiences of warm versus cold skin disinfection. Br J Nurs. 2011 Feb 10-23;20(3):148,150-1. doi: 10.12968/bjon.2011.20.3.148. PMID: 21378634. |
Wrong population, patients undergoing surgery; wrong comparison, warm vs cold skin disinfection |
|
Zhou L, Sun W. Influence of two disinfectants on the results of peripheral blood sugar monitoring. Chines Nursing Research. 2002;16(5):260-261. |
Wrong outcome, blood sugar results. Full-text not available |
|
Clévenot D, Robert S, Debaene B, Mimoz O. Analyse critique de la littérature sur l'utilisation comparée de deux antiseptiques lors du cathétérisme vasculaire ou rachidien [Critical review of the literature concerning the comparative use of two antiseptic solutions before intravascular or epidural catheterization]. Ann Fr Anesth Reanim. 2003 Nov;22(9):787-97. French. doi: 10.1016/j.annfar.2003.08.001. PMID: 14612166. |
Wrong population, patients with intravascular or epidural catheter |
|
Dawson S. Blood culture contaminants. J Hosp Infect. 2014 May;87(1):1-10. doi: 10.1016/j.jhin.2014.02.009. Epub 2014 Mar 26. PMID: 24768211. |
Wrong studydesign, narrative review of influencing factors of blood culture contamination |
|
Thom KA, Kleinberg M, Roghmann MC. Infection prevention in the cancer center. Clin Infect Dis. 2013 Aug;57(4):579-85. doi: 10.1093/cid/cit290. Epub 2013 May 7. PMID: 23652528; PMCID: PMC3726067. |
Wrong studydesign, narrative review of infection prevention program in cancer center |
|
Abdollahi F, Azizollah A. Comparing the effect of disinfectant solution of 2% chlorhexidine gluconate and 70% alcohol on prevention of phlebitis. Der Pharmacia Lettre. 2016; 8(6):129-134. |
Wrong population, patients receiving intravenous injection |
|
Alexander JW, Aerni S, Plettner JP. Development of a safe and effective one-minute preoperative skin preparation. Arch Surg. 1985 Dec;120(12):1357-61. doi: 10.1001/archsurg.1985.01390360023006. PMID: 3904673. |
Wrong population, patients undergoing preoperative skin preparation |
|
Balbuena L, Stambaugh KI, Ramirez SG, Yeager C. Effects of topical oral antiseptic rinses on bacterial counts of saliva in healthy human subjects. Otolaryngol Head Neck Surg. 1998 May;118(5):625-9. doi: 10.1177/019459989811800510. PMID: 9591860. |
Wrong comparison, differenct topical oral antiseptic; wrong outcome, bacterial load saliva |
|
Bhavsar AR, Googe JM Jr, Stockdale CR, Bressler NM, Brucker AJ, Elman MJ, Glassman AR; Diabetic Retinopathy Clinical Research Network. Risk of endophthalmitis after intravitreal drug injection when topical antibiotics are not required: the diabetic retinopathy clinical research network laser-ranibizumab-triamcinolone clinical trials. Arch Ophthalmol. 2009 Dec;127(12):1581-3. doi: 10.1001/archophthalmol.2009.304. PMID: 20008710; PMCID: PMC2874253. |
Wrong population, patients undergoing intravitreal injection |
|
Brownfield K, Peterson M. Emergency Department Observes 83% Reduction in Blood Culture Contamination with Initial Specimen Diversion Technology Adoption. American Journal of Infection Control. 2021;49(6), supplement Page S14. doi:c10.1016/j.ajic.2021.04.052. |
Wrong comparison, conventional method (venipuncture and intravenous catheter start) or initial specimen diversion technology (in tandem with venipuncture and intravenous catheter start) |
|
Cardoso S, Pereira L, Souza A, Tipple A, Pereira M, Junqueira A. (2006). Antisepsis through intravenous and intramuscular via for medicine administration. Revista Eletrônica de Enfermagem. 2006; 8(1):75-82. |
Wrong intervention, compliance with antisepsis procedures |
|
Jain A, Deshpande P, Yoon EW, Lee KS, McGeer A, Shah V. 2% aqueous vs alcohol-based chlorhexidine for skin antisepsis in VLBW neonates undergoing peripheral venipuncture: a non-inferiority trial. J Perinatol. 2022 May;42(5):636-641. doi: 10.1038/s41372-022-01337-1. Epub 2022 Feb 19. PMID: 35184146. |
Wrong population, neonates |
|
Nuntnarumit P, Sangsuksawang N. A randomized controlled trial of 1% aqueous chlorhexidine gluconate compared with 10% povidone-iodine for topical antiseptic in neonates: effects on blood culture contamination rates. Infect Control Hosp Epidemiol. 2013 Apr;34(4):430-2. doi: 10.1086/669863. Epub 2013 Feb 14. PMID: 23466918. |
Wrong population, neonates |
|
Sarmah D, Sharma B, Sharma D, Mathew S. Alcohol Used as Disinfectant before Venipuncture does not Lead to Sample Haemolysis or Sample Dilution. J Clin Diagn Res. 2016 Feb;10(2):BC16-8. doi: 10.7860/JCDR/2016/15967.7245. Epub 2016 Feb 1. PMID: 27042446; PMCID: PMC4800511. |
Wrong comparison, alcohol dry or wet; wrong outcome, sample hemolysis or sample dilution |
|
Smallman L, Burdon DW, Alexander-Williams J. The effect of skin preparation and care on the incidence of superficial thrombophlebitis. Br J Surg. 1980 Dec;67(12):861-2. doi: 10.1002/bjs.1800671208. PMID: 7448509. |
Wrong population, patients received infusion |
|
American Society of Anesthesiologists Task Force on Central Venous Access; Rupp SM, Apfelbaum JL, Blitt C, Caplan RA, Connis RT, Domino KB, Fleisher LA, Grant S, Mark JB, Morray JP, Nickinovich DG, Tung A. Practice guidelines for central venous access: a report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2012 Mar;116(3):539-73. doi: 10.1097/ALN.0b013e31823c9569. PMID: 22307320. |
Wrong population, patients received central katheter |
|
Liu W, Duan Y, Chen M. Author's response to 'Are skin antiseptics for blood culture collection really equal? Commentary on Liu, W., et al., 2016 "Skin antiseptics in venous puncture site disinfection for preventing blood culture contamination: A Bayesian network meta-analysis of randomized controlled trials"'. Int J Nurs Stud. 2017 Oct;75:81-82. doi: 10.1016/j.ijnurstu.2017.07.012. Epub 2017 Jul 22. PMID: 28755587. |
Wrong studydesign, author's response |
|
Liu W, Duan Y, Cui W, Li L, Wang X, Dai H, You C, Chen M. Skin antiseptics in venous puncture site disinfection for preventing blood culture contamination: A Bayesian network meta-analysis of randomized controlled trials. Int J Nurs Stud. 2016 Jul;59:156-62. doi: 10.1016/j.ijnurstu.2016.04.004. Epub 2016 Apr 25. PMID: 27222460. |
Concerns of comparisons between unequal antiseptic agents in meta-analyse |
Observational studies
|
Chiari P, Forni C, Fiorani A, Pezzullo O, Ricciardi V, Gazineo D, Caso L, Sabattini T, D'Alessandro F. Utilizzo dell'ipoclorito di sodio 0.05% soluzione cutanea nella antisepsi della cute prima dell'inserimento del catetere venoso periferico in adulti, bambini e neonati [Skin antisepsis with 0.05% sodium hypochlorite before the insertion of a peripheral venous catheter in adults, children and newborns]. Assist Inferm Ric. 2013 Jul-Sep;32(3):133-8. Italian. doi: 10.1702/1338.14854. PMID: 24158027. |
Wrong population, patients received katheter |
|
Khawaja, R. A. and Sikanda, R. and Qureshi, R. and Jareno, R. J. M. Routine skin preparation with 70% isopropyl alcohol swab: Is it necessary before an injection? Quasi study. Journal of the Liaquat University of Medical and Health Sciences. 2013; 12 (2) :109-114. |
Wrong comparison, with and without skin antiseptic agent |
|
Koivisto VA, Felig P. Is skin preparation necessary before insulin injection? Lancet. 1978 May 20;1(8073):1072-5. doi: 10.1016/s0140-6736(78)90916-9. PMID: 77369. |
Wrong comparison, with and without skin antiseptic agent |
|
McIvor RA, Cosbey SH. Effect of using alcoholic and non-alcoholic skin cleansing swabs when sampling blood for alcohol estimation using gas chromatography. Br J Clin Pract. 1990 Jun;44(6):235-6. PMID: 2206816. |
Wrong outcome, blood alcohol level |
|
Reinisch N, Wiedermann CJ, Ricevuti G. Inhibition of human peripheral blood neutrophil respiratory burst by alcohol-based venipuncture site disinfection. Clin Diagn Lab Immunol. 2000 Nov;7(6):980-2. doi: 10.1128/CDLI.7.6.980-982.2000. PMID: 11063510; PMCID: PMC95997. |
Wrong outcome, neutrophil respiratory burst |
|
Shahar E, Wohl-Gottesman BS, Shenkman L. Contamination of blood cultures during venepuncture: fact or myth? Postgrad Med J. 1990 Dec;66(782):1053-8. doi: 10.1136/pgmj.66.782.1053. PMID: 2084653; PMCID: PMC2429789. |
Systematic review and RCTs available on outcome blood culture contamination |
|
Arata T, Kamitani M, Miyai T, Ito M. Antiseptic effects at injection sites. Dermatology. 1997;195 Suppl 2:107-10. doi: 10.1159/000246042. PMID: 9403267. |
Wrong outcome, bacteria reduction of the disinfected skin |
|
Kiyoyama T, Tokuda Y, Shiiki S, Hachiman T, Shimasaki T, Endo K. Isopropyl alcohol compared with isopropyl alcohol plus povidone-iodine as skin preparation for prevention of blood culture contamination. J Clin Microbiol. 2009 Jan;47(1):54-8. doi: 10.1128/JCM.01425-08. Epub 2008 Oct 29. PMID: 18971366; PMCID: PMC2620854. |
Systematic review and RCTs available on outcome blood culture contamination |
|
Maeda N, Mori N, Shinjoh M, Komiyama O, Takahashi T. Comparison of 0.5% chlorhexidine gluconate alcohol with 10% povidone-iodine for skin disinfection in children to prevent blood culture contamination. J Infect Chemanother. 2021 Jul;27(7):1027-1032. doi: 10.1016/j.jiac.2021.02.027. Epub 2021 Mar 13. PMID: 33727027. |
Systematic review and RCTs available on outcome blood culture contamination |
|
McLellan E, Townsend R, Parsons HK. Evaluation of ChloraPrep (2% chlorhexidine gluconate in 70% isopropyl alcohol) for skin antisepsis in preparation for blood culture collection. J Infect. 2008 Dec;57(6):459-63. doi: 10.1016/j.jinf.2008.08.012. Epub 2008 Oct 10. PMID: 18848729. |
Systematic review and RCTs available on outcome blood culture contamination |
|
Ota K, Nishioka D, Ito Y, Hamada E, Mori N, Nishii T, Ota K, Shibata Y, Takasu A. Regression discontinuity of blood culture contamination rate after changing of disinfectants: retrospective observational study. Sci Rep. 2021 Oct 27;11(1):21235. doi: 10.1038/s41598-021-00498-x. PMID: 34707137; PMCID: PMC8551281. |
Systematic review and RCTs available on outcome blood culture contamination |
|
Ota K, Oba K, Fukui K, Ito Y, Hamada E, Mori N, Oka M, Ota K, Shibata Y, Takasu A. Sites of blood collection and topical antiseptics associated with contaminated cultures: prospective observational study. Sci Rep. 2021 Mar 18;11(1):6211. doi: 10.1038/s41598-021-85614-7. PMID: 33737624; PMCID: PMC7973780. |
Systematic review and RCTs available on outcome blood culture contamination |
Bekijk de Risk-of-bias-tabel:
Bijlagen
|
Begrip |
Definitie |
|---|---|
|
Algemene voorzorgsmaatregelen |
Maatregelen die bij elke patiënt ongeacht zijn/haar infectiestatus of kolonisatie van toepassing zijn. Deze maatregelen staan beschreven in de SRI (Samenwerkingsverband Richtlijnen Infectiepreventie )-richtlijnen Handhygiëne & persoonlijke hygiëne medewerker, Persoonlijke beschermingsmiddelen, Reiniging & desinfectie van ruimten en Accidenteel bloedcontact. |
|
Infectie |
Interactie tussen het micro-organisme en de gastheer leidt tot schade of een veranderde fysiologie bij de gastheer. De schade of veranderde fysiologie kan resulteren in klinisch waarneembare symptomen en verschijnselen maar ook langdurig onopgemerkt blijven of subklinisch verlopen. |
|
Rondom het oog |
Hiermee wordt perioculair bedoeld. |
|
Transmissie |
Overdracht van micro-organismen. |
|
Wondclassificaties |
Ingrepen worden aan de hand van de wondclassificatie (CDC) ingedeeld in de volgende categorieën, die correleren met het risico op postoperatieve wondinfecties: 1) schoon 2) schoon-besmet 3) besmet en 4) vuil). Een schone wond valt daarom onder categorie 1. Een niet-schone wond valt onder categorie 2, 3 of 4.
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld volgens de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten waarbij de huid wordt gedesinfecteerd voorafgaand aan een ingreep, punctie/biopsie en injectie. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere WIP-richtlijnen Desinfectie huid en slijmvliezen en Puncties op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door IGJ, KNMP (Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie ), NAPA (Nederlandse Associatie Physician Assistants ), NOG (Nederlands Oogheelkundig Gezelschap ), NVAB (Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde ), NVALT (Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose ), NVvC, NVDV (Nederlandse Vereniging voor Dermatologie en Venereologie ), NVIC, NVK (Nederlandse Vereniging voor Kindergeneeskunde ), NVKC, NVKF (Nederlandse Vereniging voor Klinische Fysica ), NVKG, NVMM (Nederlandse Vereniging voor Medische Microbiologie ), NVPC, NVU, NVvA (Nederlandse Vereniging voor Arbeidshygiëne ), NVR, NVvR (Nederlandse Vereniging voor Radiologie ), NVZ, NVZA (Nederlandse Vereniging van Ziekenhuisapothekers ), SNV, VCCN, VDSMH (Vereniging Deskundigen Steriele Medische Hulpmiddelen ), Verenso (Vereniging van specialisten ouderengeneeskunde ) en VHIG (Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg ) via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Ook definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder Zoeken en selecteren onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|---|---|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimaal klinisch relevant verschil (minimal clinically important difference (MCID)). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming over de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Minimal Clinically Important Difference ) (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje Overwegingen en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision-framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision-framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Volgens de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|---|---|---|
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntfederatie Nederland (PFNL) voor de schriftelijke knelpuntenanalyse. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is ook voor commentaar voorgelegd aan PFNL (Patiëntfederatie Nederland ) en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz (Wet kwaliteit, klachten en geschillen zorg ) & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is in overeenstemming met de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|---|---|---|
|
Module 1. Huiddesinfectie |
||
|
Module 1.1. Ingrepen algemeen |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1.2 Bloedafname en injecties |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1.3 Hoofd-halsgebied en oog |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het overgrote deel (± 90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 1.4 Prematuren/neonaten |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het overgrote deel (± 90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 2. Algemene voorzorgsmaatregelen |
||
|
Module 2.1 Punctie/biopsie/injectie buiten het OK-complex |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft]. Er worden daarom geen financiële gevolgen verwacht. |
|
Module 2.2 Intra-articulaire injectie/punctie |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het overgrote deel (± 90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in healthcare. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013.
Inleiding
Dit implementatieplan is opgesteld om de implementatie van de aanbevelingen in de richtlijn infectiepreventie Desinfectie huid en slijmvliezen plus puncties te borgen. Voor het opstellen van dit plan heeft de werkgroep per ontwikkelde module beoordeeld wat eventueel bevorderende en belemmerende factoren zijn voor het naleven van de aanbevelingen en wat eventueel nodig is om de aanbevolen infectiepreventiemaatregelen in Nederland te implementeren.
Werkwijze
De werkgroep heeft per aanbeveling binnen de modules geïnventariseerd:
- wat een realistische termijn voor implementatie is;
- de verwachtte effect van implementatie op de zorgkosten;
- randvoorwaarden om de aanbeveling tijdig te implementeren;
- mogelijk barrières voor implementatie;
- te ondernemen acties voor (bevordering van) implementatie;
- verantwoordelijke partij voor de te ondernemen acties.
Hieronder is een tabel (Tabel 1) opgenomen met alle modules uit deze richtlijn met daarbij de bijhorende implementatietermijn, verwacht effect op kosten, mogelijke barrières voor implementatie, te ondernemen acties voor implementatie en verantwoordelijken voor de acties.
Tabel 1. Implementatieplan
|
Module |
Tijdspad voor implementatie |
Verwacht effect op de kosten |
Mogelijke barrières voor implementatie |
Te ondernemen acties voor implementatie |
Verantwoordelijke voor acties
|
|---|---|---|---|---|---|
|
Noodzaak huid- en slijmvliesdesinfectie ingrepen |
< 1 jaar |
Kosten zullen ongeveer gelijk blijven |
Door voor ingrepen buiten de operatiekamer andere concentraties van het aanbevolen middel mee te nemen als er sprake is van onvoldoende beschikbaarheid van het middel, worden geen barrières voor implementatie verwacht. |
Verspreiden richtlijn en voorlichting zorgmedewerkers |
Professionals |
|
Huiddesinfectiemiddel hoofd-/hals en oog |
< 1 jaar |
Kosten zullen ongeveer gelijk blijven |
Geen, sluit aan bij huidige praktijk |
Verspreiden richtlijn en voorlichting zorgmedewerkers |
Professionals |
|
Huiddesinfectie bloedafname ja/nee |
< 1 jaar |
De kosten voor instellingen die voorheen geen huiddesinfectie toepasten zullen toenemen, echter er is geen sprake van een substantiële toename van kosten in z’n totaliteit. |
Mogelijk weerstand tegen een verandering in werkwijze |
Verspreiden richtlijn en voorlichting medewerkers |
Professionals |
|
Huiddesinfectie injectie ja/nee
|
< 1 jaar |
De kosten voor instellingen die voorheen wel huiddesinfectie toepasten zullen afnemen, echter er is geen sprake van een substantiële afname van kosten in z’n totaliteit. |
Mogelijk weerstand tegen een verandering in werkwijze |
Verspreiden richtlijn en voorlichting medewerkers |
Professionals |
|
Huiddesinfectiemiddel bloedafname en injectie
|
< 1 jaar |
Kosten zullen mogelijk minder worden door minder vaak bij injecties huiddesinfectie toe te passen. |
Geen, sluit aan bij huidige praktijk |
Verspreiden richtlijn en voorlichting medewerkers |
Professionals |
|
Huiddesinfectie prematuren/neonaten |
< 1 jaar |
Kosten zullen nagenoeg gelijk blijven. |
Geen, sluit aan bij huidige praktijk |
Verspreiden richtlijn en voorlichting zorgmedewerkers |
Professionals |
|
Algemene voorzorgsmaatregelen punctie |
< 1 jaar |
Kosten zullen nagenoeg gelijk blijven. |
Geen, sluit aan bij huidige praktijk |
Verspreiden richtlijn en voorlichting zorgmedewerkers |
Professionals |
|
Intra-articulaire injectie |
< 1 jaar |
Kosten zullen nagenoeg gelijk blijven. |
Geen, sluit aan bij huidige praktijk |
Verspreiden richtlijn en voorlichting zorgmedewerkers |
Professionals |
Termijn voor implementatie
Omdat de aanbevelingen in het algemeen nauw aansluiten bij de huidige klinische praktijk, voorziet de werkgroep nauwelijks belemmeringen voor implementatie. Als men ervan uitgaat dat alle betrokken zorgprofessionals vanaf autorisatie van deze richtlijn (voorzien begin 2024) binnen een jaar op de hoogte gesteld worden van deze richtlijn, is implementatie van de aanbevelingen vanaf een jaar later (begin 2025) realistisch en haalbaar.
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijke verenigingen/beroepsorganisaties
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn door er over te vertellen op congressen.
- Ontwikkelen van gerichte bijscholing/trainingen om kennisoverdracht tussen medewerkers te faciliteren/stimuleren.
- Ontwikkelen en aanpassen van infectiepreventieprotocollen.
De lokale vakgroepen/individuele medisch professionals
- Het bespreken van de aanbevelingen in de multidisciplinaire teamoverleggen, vakgroepoverleggen en relevante lokale werkgroepen.
- Aanpassen lokale infectiepreventieprotocollen.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
Samenwerkingsverband Richtlijnen Infectiepreventie (SRI):
- Toevoegen van de richtlijn aan de SRI (Samenwerkingsverband Richtlijnen Infectiepreventie )-website.
- Toevoegen van richtlijn aan richtlijnendatabase.
- Het implementatieplan wordt in de bijlage opgenomen, zodat deze voor op een voor alle partijen goed te vinden is.
- De kennislacunes worden opgenomen in de bijlagen.
Indicatoren
Voor deze richtlijn zijn geen indicatoren ontwikkeld.
Tijdens de ontwikkeling van de richtlijn Desinfectie huid en slijmvliezen plus puncties is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven waar wetenschappelijke kennis beperkt is en dus op welke vlakken nader onderzoek gewenst is.
Module 1 Huiddesinfectie
Module 1.1 Huiddesinfectie ingrepen algemeen
Geen systematische search uitgevoerd.
Module 1.2 Bloedafname en injectie
Het is onduidelijk wat de plaats is van huiddesinfectie voorafgaand aan bloedafname ten behoeve van diagnostiek en keuringen op het voorkómen van een (lokale/systemische) infectie bij de patiënt?
Het is onduidelijk wat de plaats is van huiddesinfectie voorafgaand aan een intramusculaire, subcutane of intradermale injectie op het voorkómen van een infectie bij de patiënt?
Het is onduidelijk welk huiddesinfectiemiddel de voorkeur heeft om voorafgaand aan een bloedafname en/of een injectie (intramusculair, subcutaan, intradermaal) te gebruiken, om een infectie bij de patiënt te voorkómen en in geval van bloedafname het risico op contaminatie van het bloedmonster te reduceren? Echter de werkgroep is van mening dat de praktijk hierdoor niet gehinderd wordt en voert deze daarom niet als kennislacune op.
Module 1.3 Hoofd-halsgebied en oog
Er is onvoldoende bewijs over de optimale concentratie van povidonjodium voor desinfectie van het oogoppervlak.
Module 1.4 Prematuren/neonaten
Tot op heden is de vraag welk huiddesinfectiemiddel effectief en het meest veilig is in gebruik bij prematuren en neonaten niet uitgebreid onderzocht.
Module 2. Algemene voorzorgsmaatregelen Punctie/biopsie/injectie
Module 2.1 Punctie/biopsie/injectie
Bij nieuwe ontwikkelingen/interventies in de gezondheidszorg, waaronder puncties, zal op basis van best practices een keuze gemaakt worden over de te treffen infectiepreventiemaatregelen in overleg met de behandelaar. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op de noodzaak voor welke maatregelen uit het oogpunt van infectiepreventie nodig zijn en in het kader van de Greendeal niet onnodig getroffen worden.
Module 2.2 Intra-articulaire injectie
Wat is het effect van infectiepreventiemaatregelen op het ontstaan van zorggerelateerde infecties na een intra-articulaire injectie of punctie?
Overig/toekomstige knelpunten
Er is tot nu toe onvoldoende bekend over de aspecten voor duurzaamheid in relatie tot de voorkeur voor een bepaald desinfectiemiddel.
Bekijk de pdf met het overzicht van de ontvangen reacties voor een schriftelijke knelpuntenanalyse voor deze richtlijn.