Module 1 Indicaties
Uitgangsvraag
Wat zijn de indicaties voor het gebruik van een blaaskatheter?
De uitgangsvraag omvat de volgende deelvragen:
- Wat zijn indicaties voor het gebruik van een transurethrale katheter?
- Wat zijn mogelijke alternatieven voor een transurethrale katheter (suprapubische katheter, externe katheter (condoomkatheter) intermitterende katheterisatie)?
- Wat is de optimale timing voor het verwijderen van een transurethrale katheter (katheterisatieduur, periodieke evaluatie van de indicatie)?
Aanbevelingen
Aanbeveling 1
- Breng alleen een transurethrale verblijfskatheter in bij een patiënt wanneer er sprake is van één of meer terechte indicatie(s), zoals:
- Groot urineresidu in de blaas/afvloedbelemmering
- Monitoren urineproductie onder niet operatieve omstandigheden bij ernstig zieke patiënt
- Peri- of postoperatief gebruik, duur volgens (lokaal) protocol
- Neurogene (overloop)blaas
- Incontinentie in aanwezigheid open perianale of sacrale wond
- Toediening van medicatie in de blaas/blaasspoelen bij bloedingen
- Verbetering van kwaliteit van leven in de stervensfase
Overweeg het gebruik van alternatieven zoals continentiemateriaal, externe katheter (condoomkatheter), suprapubische katheter en intermitterend katheteriseren.
Aanbeveling 2
- Overweeg een suprapubische katheter bij een indicatie voor langdurige katheterisatie, met name wanneer er sprake is van mechanische klachten van een transurethrale verblijfskatheter of eventueel bij recidiverende infecties.
Aanbeveling 3
- Verwijder de transurethrale verblijfskatheter zo snel mogelijk.
- Evalueer daartoe dagelijks (of regelmatig in geval van langdurige katheterisatie) of de indicatie tot katheterisatie nog bestaat.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het gebruik van transurethrale katheter (TUC’s) is een belangrijke risicofactor voor het ontstaan van een urineweginfectie in het ziekenhuis en de langdurige zorg. Beperking van het gebruik van TUC’s kan worden bereikt door een strikte indicatiestelling te hanteren voor het inbrengen van een TUC en wanneer er een indicatie is, zo mogelijk alternatieven te gebruiken. In verscheidene onderzoeken naar het gebruik van TUC’s in ziekenhuizen is het oordeel dat een groot deel van de katheters zijn ingebracht zonder een gerechtvaardigde indicatie of er geen gerechtvaardigde indicatie meer bestaat (Laan, 2020a; Laan, 2020b; Bentvelsen, 2022).
Deelvraag 1 Indicatie voor een TUC
Voor deelvraag 1 konden geen studies uit de wetenschappelijke literatuur worden geïncludeerd.
Voor een overzicht van terechte en onterechte indicaties, zie de criteria van PREventie van ZIEkenhuisinfecties door Surveillance (PREZIES) en de RICAT-studie (Laan, 2020a).
Deelvraag 2 Alternatieven voor een TUC
Voor deelvraag 2 werd de systematische review van Kidd (2015) geïncludeerd. Kidd (2015) voerde een meta-analyse uit en vergeleek het voorkomen van urineweginfectie en bacteriurie bij patiënten die kortdurend (<14 dagen) een TUC of suprapubische katheter kregen of intermitterende katheterisatie. Het grootste gedeelte van de geïncludeerde studies beschreef patiënten die een operatie ondergingen.
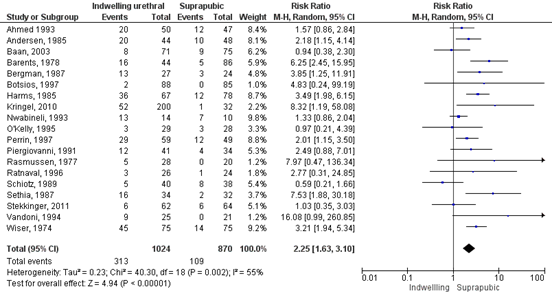
Voor de uitkomstmaat urineweginfecties is de bewijskracht beoordeeld als zeer laag voor alle vergelijkingen. Voor de uitkomstmaat bacteriurie is alleen voor de vergelijking TUC versus suprapubische katheter het bewijs beoordeeld als laag. Het wetenschappelijk bewijs suggereert dat minder patiënten een bacteriurie krijgen wanneer zij een suprapubische katheter hebben dan patiënten met een TUC (RR 2.25; 95% CI 1.63 tot 3.10). Voor de andere vergelijkingen is de kwaliteit van het bewijs beoordeeld als zeer laag.
Alternatieven voor een TUC zijn continentiemateriaal, externe katheter (condoomkatheter), suprapubische katheter en intermitterend katheteriseren. De voor- en nadelen van deze alternatieven worden hieronder beschreven.
Alternatieven voor een urethra-verblijfskatheter zijn:
Continentiemateriaal
Bij patiënten met incontinentie voor urine verdient het gebruik van continentiematerialen de voorkeur boven een TUC. Door het gebruik van continentiemateriaal in plaats van een TUC wordt de belangrijkste risicofactor voor het optreden van een urineweginfectie vermeden. De patiënt moet geregeld continentiemateriaal krijgen. De frequentie van vervangen hangt af van de urineproductie. Uitgangspunt is dat alle urine geabsorbeerd moet worden, zodat de huid van de patiënt steeds droog blijft. Voor opvang van urine en feces via continentiemateriaal wordt ook verwezen naar de richtlijn Opvang en afvoer van urine en feces.
Externe katheter (condoomkatheter)
Bij mannen met incontinentie voor urine is een externe katheter (condoomkatheter) een geschikt alternatief voor het gebruik van continentiemateriaal of een TUC. Door het gebruik van een externe katheter (condoomkatheter) in plaats van een TUC wordt de belangrijkste risicofactor voor het krijgen van een infectie vermeden. Een externe katheter (condoomkatheter) mag niet te strak zitten of te wijd zijn en moet dagelijks worden vervangen. De externe katheter (condoomkatheter) kan op een eenvoudige urineopvangzak met aftappunt worden aangesloten.
Intermitterende katheterisatie
Het voordeel van intermitterend katheteriseren is dat er geen katheter achterblijft in de blaas, waardoor de patiënt hiervan minder ongemak heeft. Het nadeel is dat er door de patiënt zelf, of een hulpverlener meerdere keren per dag een katheter moet worden ingebracht om een goede blaaslediging te garanderen. Als de patiënt hiertoe qua conditie en coördinatie in staat is, is deze procedure relatief makkelijk zelf aan te leren, waardoor de autonomie van de patiënt wordt versterkt. Dit laatste is vooral van toepassing in situaties waarbij door gestoorde blaaslediging langdurig katheterisatie nodig zal zijn.
De voorkeuren van de patiënt spelen hierbij een belangrijke rol.
Er zijn met betrekking tot het infectierisico geen gegevens op grond waarvan een algemene uitspraak kan worden gedaan dat intermitterende katheterisatie de voorkeur verdient boven verblijfskatheterisatie.
Suprapubische katheterisatie
Bovenstaand literatuuronderzoek toont dat er mogelijk minder bacteriurie voorkomt bij het gebruik van een suprapubische katheter in vergelijking met een TUC. Daarnaast beschrijft het Cochrane Review van Kidd (2015) ook andere voordelen. De suprapubische katheters werden in de meeste gevallen in de operatiekamer ingebracht, terwijl de studiedeelnemers onder narcose waren. Bij patiënten met een TUC was de kans om opnieuw gekatheteriseerd te moeten worden viermaal zo hoog en de kans op ongemak driemaal zo hoog als wanneer een suprapubische katheter was ingebracht. Nadeel van de suprapubische katheter is dat deze moet worden ingebracht via de buikwand, en dit dus een (weliswaar relatief eenvoudige) invasieve procedure is met een kleine kans op complicaties. De vraag is of de resultaten van Kidd 2015 zonder meer geëxtrapoleerd kunnen worden naar patiënten die geen operatie ondergaan, of een andere type operatie, waarbij bijvoorbeeld het inbrengen van de suprapubische katheter een aparte ingreep is en niet als onderdeel van de operatie zelf wordt uitgevoerd.
De meerwaarde van de suprapubische katheter zal vooral tot zijn recht komen bij langer durende katheterisatie. Daarom beveelt de werkgroep aan een suprapubische katheter te overwegen bij een indicatie voor langdurige katheterisatie, met name wanneer er sprake is van mechanische klachten (zoals bv decubitus) van een TUC. Ook kan het gebruik van een suprapubische katheter worden overwogen bij recidiverende infecties. Hierbij moet het mogelijk lagere risico op recidiverende infecties afgewogen worden tegen het kleine risico van een ernstige complicatie (zoals een bloeding of darmperforatie).
Deelvraag 3 Duur van TUC
De katheterisatieduur is een belangrijke risicofactor voor het ontstaan van een urineweginfectie bij een patiënt met een TUC.
Uit het literatuuronderzoek werd de systematische review van Ellahi (2021) geïncludeerd voor de uitkomstmaat urineweginfectie. Voor de uitkomstmaat bacteriurie werden nog twee RCT’s (Atılgan, 2020; Igbodike, 2021) toegevoegd aan de systematische review van Ellahi (2021). Ellahi (2021) voerde een meta-analyse uit waarin het moment van verwijderen van een TUC werd vergeleken (vroeg verwijderen versus later verwijderen, per studie werd een andere definitie van vroeg en laat gehanteerd) op de uitkomstmaten urineweginfectie en bacteriurie. Voor de uitkomstmaat urineweginfectie berekende Ellahi een gepoolde risk ratio van 0.52 (95% CI 0.45 tot 0.61) in het voordeel van vroeg verwijderen. Dit is een klinisch relevant verschil. De bewijskracht is beoordeeld als moderate. Het vroeg verwijderen van een TUC reduceert waarschijnlijk het aantal urineweginfecties in vergelijking met laat verwijderen. Voor de uitkomstmaat bacteriurie berekende we op basis van Ellahi, Atılgan, en Igbodike een gepoolde risk ratio van 0.47 (95% CI 0.38 to 0.57) in het voordeel van vroeg verwijderen. Dit is een klinisch relevant verschil. Het vroeg verwijderen van een TUC reduceert het ontstaan van een bacteriurie in vergelijking met laat verwijderen. De kwaliteit van het bewijs is moderate.
Wanneer een TUC wordt toegepast, moet dit voor zo kort mogelijke duur zijn.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De voorkeuren van de patiënt zoals bijvoorbeeld wensen ten aanzien van seksualiteit/intimiteit moeten worden meegewogen in de keuze tussen een TUC en suprapubische katheter. De verschillende typen katheters hebben verschillende voor- en nadelen die individuele patiënten anders kunnen wegen. De voorkeuren van patiënten zijn voor deze keuze dan ook erg persoonlijk. Daarom is het belangrijk om ‘samen beslissen’ toe te passen. Hierbij staan de medische mogelijkheden én persoonlijke voorkeuren van de patiënt centraal. Om dit te kunnen doen worden alle behandelmogelijkheden (inclusief niet-behandelen) samen met hun voor- en nadelen en eventuele late gevolgen en effecten besproken met de patiënt. Goede informatie die op de patiënt is afgestemd is hierin belangrijk.
Kosten (middelenbeslag)
Het inbrengen van een suprapubische katheter brengt meer kosten met zich mee dan intermitterend katheteriseren of het plaatsen van een TUC. Wanneer er zowel op medische gronden als op patiëntvoorkeuren geen voorkeur is voor het type katheter dan kunnen kosten meewegen in de keuze.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen problemen in de aanvaardbaarheid, haalbaarheid en implementatie omdat de beschreven infectiepreventiemaatregelen niet afwijken van de huidige situatie.
Duurzaamheid
De werkgroep is van mening dat duurzaamheid een belangrijk aspect is bij de keuze van het type katheter. In het geval van intermitterend katheteriseren worden per dag meerdere katheters gebruikt. Momenteel loopt een studie (COMPARE) naar het hergebruik van deze katheters, maar de resultaten daarvan zijn nog niet gepubliceerd (van Doorn, 2022).
Rationale van de aanbeveling
Aanbeveling 1
Gezien het risico op urineweginfecties moet een transurethrale verblijfskatheter (TUC) alleen worden overwogen als daartoe een terechte indicatie bestaat. Indicaties voor inbrengen van een TUC zijn onder andere een operatie, monitoren van de urineproductie en opheffen van urineretentie door afvloedbelemmering, onvolledige blaaslediging (bijvoorbeeld neurogene blaas) (zie PREZIES voor de volledige lijst met indicaties).
Maak in geval van incontinentie, verwarde patiënt of ongemak voor de patiënt (zoals immobilisatie waardoor normale mictie niet mogelijk is), bij voorkeur gebruik van alternatieve niet-invasieve methoden, zoals continentiemateriaal of een externe katheter (condoomkatheter).
Er kunnen zich situaties voordoen waarbij een TUC toch wordt overwogen (bijvoorbeeld bij pijnlijke huidlaesies, om de huid intact te houden bij incontinentie als conservatieve behandelmethoden niet hebben gewerkt; of om indien nodig het comfort te verhogen rondom het levenseinde), hierbij moet het nadeel van het risico op een urineweginfectie in de besluitvorming worden meegewogen.
Aanbeveling 2
Er zijn geen gegevens op grond waarvan een algemene uitspraak kan worden gebaseerd dat intermitterende katheterisatie de voorkeur verdient boven verblijfskatheterisatie qua infectierisico. Belangrijk is om in het geval van langdurige katheterisatie het type van katheterisatie te bespreken met de patiënt. Neem hierbij de indicatie, verwachte duur van katheterisatie en voorkeuren van de patiënt in overweging volgens het principe ‘Samen beslissen’
De meerwaarde van de suprapubische katheter zal vooral tot zijn recht komen bij langer durende katheterisatie. Daarom beveelt de werkgroep aan een suprapubische katheter te overwegen bij een indicatie voor langdurige katheterisatie.
Aanbeveling 3
Zo vroeg mogelijk verwijderen van de TUC reduceert het optreden van bacteriurie en waarschijnlijk het aantal urineweginfecties. Beoordeel dagelijks (of bij langdurige katheterisatie regelmatig) of de indicatie voor de katheterisatie nog bestaat en verwijder de TUC zo snel mogelijk. Voorlichting van de patiënt over het belang van vroegtijdige verwijdering kan bijdragen aan verhoogde alertheid op de indicatie en autonomie van de patiënt.
Onderbouwing
Autorisatiedatum: 25 juni 2024
Eerstvolgende beoordeling actualiteit: 2026
Initiatief:
- Samenwerkingsverband Richtlijnen Infectiepreventie (SRI)
Geautoriseerd door:
- Nederlandse Vereniging van Internist-Infectiologen (NIV/NVII)
- Nederlandse Vereniging van Medische Microbiologie (NVMM)
- Nederlandse Vereniging voor Urologie (NVU)
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG (Nederlandse Vereniging voor Obstetrie en Gynaecologie ))
- Nederlandse Orthopaedische Vereniging (NOV)
- Nederlandse Vereniging van Revalidatieartsen (VRA (Nederlandse Vereniging van Revalidatieartsen ))
- Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg (VHIG)
- Verpleegkundigen & Verzorgenden Nederland (V & VN)
- Patiëntenfederatie Nederland (PFNL (Patiëntfederatie Nederland ))
Regiehouder:
- SRI (Samenwerkingsverband Richtlijnen Infectiepreventie )
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd door het ministerie van VWS (Ministerie van Volksgezondheid, Welzijn en Sport). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Urineweginfecties zijn de meest voorkomende nosocomiale infecties, het merendeel daarvan is kathetergerelateerd. Door de aanwezigheid van een katheter in de blaas kunnen bacteriën eenvoudiger de blaas bereiken. Dat kan gebeuren bij het inbrengen van de katheter waarbij bacteriën vanuit de urethra de blaas in kunnen worden gebracht, of later via de buitenkant of de binnenkant van de katheter. Via de buitenkant van de katheter (de extraluminale weg) verplaatsen bacteriën zich van de meatus urethrae naar de blaas. Bacteriële kolonisatie via deze route komt het meest frequent voor (Maki, 2001). Bij de intraluminale weg vindt eerst contaminatie van het drainagesysteem plaats. Daarna wordt migratie van bacteriën naar de blaas bevorderd door reflux van urine die kan optreden wanneer het drainagesysteem niet goed functioneert. Anders dan vroeger werd aangenomen, is de blaas geen steriele omgeving (Siddiqui, 2011; Hilt, 2014). Ook bij mensen zonder blaaskatheter komt kolonisatie van de blaas met bacteriën voor. De kans op significante bacteriurie is onder andere groter bij ouderen en bij mensen met een gestoorde blaaslediging (Nicolle, 2019). Ook de aanwezigheid van een verblijfskatheter draagt hieraan bij. Doordat bacteriën een biofilm vormen op het kunstmateriaal van de katheter kunnen zij zich makkelijker handhaven vermenigvuldigen en kolonisatie of ontsteking veroorzaken (Liedl, 2001).
Bacteriurie kan vaak binnen 48 uur na plaatsing van een verblijfskatheter worden aangetoond. Er is echter een hoger risico op bacteriële groei naarmate de katheter langer blijft zitten. Daarom wordt aanbevolen om de katheter zo snel mogelijk te verwijderen als deze niet langer nodig is om het risico op infectie te verminderen.
Het is van belang kolonisatie van de blaas met bacteriën (bacteriurie) te onderscheiden van een urineweginfectie, waarbij de patiënt daarvan klachten en ziekteverschijnselen heeft. Dit omdat een urineweginfectie veelal behandeld moet worden met antibiotica, waar antibiotica bij asymptomatische bacteriurie niet geïndiceerd zijn en veelal slechts nadelige effecten hebben (Nicolle, 2019).
De meest voorkomende indicaties voor het inbrengen van een transurethrale verblijfskatheter (TUC) zijn operatie, monitoren van de urineproductie en opheffen van urineretentie door afvloedbelemmering.
Deze module beschrijft adviezen op basis van het wetenschappelijk bewijs voor de indicaties van katheterisaties, gebruik van verschillende vormen van katheterisatie en het verwijderen hiervan.
A review of the literature was performed and the WIP-guideline Preventie van infecties als gevolg van blaaskatheterisatie via de urethra and were used to answer the following question:
-
What are the indications for a transurethral catheter?
P: Patients with a urinary catheter
I: -
C: -
O: Urinary tract infection, bacteriuria
-
Wat are the alternatives for a transurethral catheter?
P: Patients with a urinary catheter
I: Indwelling urethral catheterisation/intermittent catheterisation/ suprapubic catheterisation
C: Indwelling urethral catheterisation/intermittent catheterisation/ suprapubic catheterisation
O: Urinary tract infection, bacteriuria
-
When should a urinary catheter be removed?
P: Patients with a urinary catheter
I: Removal at moment X
C: Removal at moment Y
O: Urinary tract infection, bacteriuria
Relevant outcome measures
The guideline development group considered urinary tract infection as a critical outcome measure for decision making; and bacteriuria as an important outcome measure for decision making. A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. The working group defined a limit of 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25), and 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (methods)
The databases Embase (via embase.com) was searched with relevant search terms from 2012 until 3 November 2022 for systematic reviews and RCTs. The systematic literature search resulted in 532 hits. Studies were selected based on criteria as mentioned in the PICO and published in English or Dutch. Thirteen studies were initially selected based on title and abstract screening. After reading the full text, nine studies were excluded (see the table with reasons for exclusion), and four studies were included.
Results
No study was included regarding sub-question one. One study was included in the analysis of the literature regarding sub-question two and three studies were included regarding sub-question three. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Description of studies
Sub-question 1 What are the indications for a transurethral catheter?
Not applicable.
Sub-question 2 Wat are the alternatives for a transurethral catheter?
Kidd (2015) performed a systematic review and meta-analysis to determine the advantages and disadvantages of alternative routes of short-term bladder catheterisation in adults in terms of infection, adverse events, replacement, duration of use, participant satisfaction and cost effectiveness. ‘Short-term’ was defined as catheterisation for 14 days or less. The Cochrane Incontinence Group Specialised Register was searched, which contains trials identified from the Cochrane Central Register of Controlled Trials (CENTRAL), Medlin, Medline in process, ClinicalTrials.gov, WHO ICTRP and handsearching of journals and conference proceedings (searched 26 February 2015), Cinahl (searched 27 January 2015) and the reference lists of relevant articles. All randomized and quasi-randomised trials comparing different routes of catheterisation for short-term use in hospitalized adults were included. At least two review authors extracted data and performed ‘Risk of bias’ assessment of the included trials. Forty-two trials were included in the systematic review. Twenty-five trials compared indwelling urethral and suprapubic catheterisation. Fourteen trials compared indwelling urethral catheterisation with intermittent catheterisation. Three trials compared intermittent catheterisation with suprapubic catheterisation. Trials that said they were reporting UTI were actually reporting asymptomatic bacteriuria (without clinical symptoms) were reclassified by the authors.
Sub-question 3 When should a urinary catheter be removed?
Ellahi (2021) performed a systematic review and meta-analysis to assess the effects of strategies for removing short-term (14 days or less) indwelling catheters in adults. Ellahi included the comparison ‘shorter versus longer duration of catheter removal’. The Cochrane Incontinence Specialised Register was searched, which contains trials identified from CENTRAL, Medline, Medline InProcess, Medline Epub Ahead of Print, Cinahl, ClinicalTrials.gov, WHO ICTRP, and handsearching of journals and conference proceedings (searched 17 March 2020), and reference lists of relevant articles. Randomised controlled trials and quasi-RCTs that evaluated the effectiveness of practices undertaken for the removal of short-term indwelling urethral catheters in adults for any reason in any setting. Two review authors performed abstract and full-text screening of all relevant articles. Sixty-eight trials (9247 participants) compared shorter durations of indwelling urethral catheterisation versus longer durations of indwelling urethral catheterisation. Most participants across the trials had undergone some form of surgical procedure.
Atılgan (2020) conducted an RCT to compare the effects of early versus delayed catheter removal after tension-free vaginal tape (TVT) on the outcome measure bacteriuria.
Patients with stress urinary incontinence observed with cough stress test or intrinsic sphincter deficiency detected on urodynamic evaluation were included. Patients with pelvic organ prolapse, positive or unavailable preoperative urine culture report, comorbid systemic illness, and TVT performed with benign or malign gynaecologic surgeries were excluded from the study. In one group the catheter was removed within first 6 h after surgery (0–6 h) and in the other group the catheter was removed 24 h later. Seventy patients performed TVT for stress urinary incontinence were enrolled in this study and equally assigned to two groups. All patients received 1 g antibiotic prophylaxis while starting surgery and continued twice a day postoperatively. Standard 16F Foley’s catheter was used.
Igbodike (2021) conducted an RCT to compare the effects of catheter removal 8-h post elective caesarean section and 24-h on the outcome measure bacteriuria. The eligibility criteria were elective caesarean delivery between 34 weeks and 40 weeks, spinal anaesthesia and absence of pre-operative significant bacteriuria or UTI. Patients with intra-operative bladder injury and those that required conversion to general anaesthesia were excluded. Participants (150 in each arm) were randomly assigned (1:1 ratio) to either 8-h or 24-h group. Primary outcome measure was rate of significant bacteriuria 48-h post-operatively.
Results
Sub-question 1 What are the indications for a transurethral catheter?
Not applicable.
Sub-question two Wat are the alternatives for a transurethral catheter?
- Comparison Indwelling urethral catheter versus suprapubic catheter
Outcome: symptomatic UTI
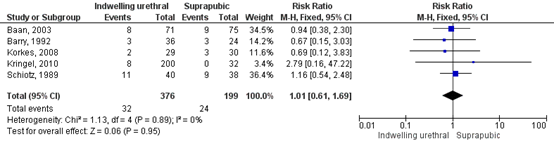
Kidd (2015) conducted a meta-analysis including 5 studies (n=575) and calculated a pooled risk ratio of 1.01 (0.61, 1.69) in favour of a suprapubic catheter. This means that fewer patients with a suprapubic catheter experienced a urinary tract infection compared to patients with an indwelling urethral catheter This is not a clinically relevant difference. The heterogeneity was low (I2=0).
Figure 1: Indwelling urethral catheter versus suprapubic catheter (outcome UTI)
Outcome: bacteriuria
For the outcome measure bacteriuria, Kidd (2015) conducted a meta-analysis and included 19 studies (n=1894). The pooled RR was 2.25 (95% CI 1.63 to 3.10) in favour of suprapubic catheter. This means that fewer patients with a suprapubic catheter experienced bacteriuria compared to patients with an indwelling urethral catheter. This is a clinically relevant difference. There was evidence of heterogeneity between trials (I2 = 55%) and subgroup analysis were performed (gender, type of surgery, with or without antibiotic prophylaxis, moment of collection of urine sample). All subgroup analysis favoured suprapubic catheterisation. There was some evidence of publication bias by interpretation of the funnel plot.
Figure 2: Indwelling urethral catheter versus suprapubic catheter (outcome bacteriuria)
- Comparison Indwelling urethral catheterisation versus intermittent catheterisation
Outcome: symptomatic UTI
Kidd included two trials for symptomatic UTI. Due to clinical and statistical heterogeneity, the results could not be pooled (one study included patients for urogenital surgery (Hakvoort), the other study included elderly women in the geriatric rehabilitation ward (Tang). One study, Hakvoort (2011) (n=87) calculated a risk ratio of 2.79 (95%CI: 1.09 - 7.14) in favour of intermittent catheterisation. The other study, Tang (2006) (n=56) calculated a risk ratio of 0.22 (95%CI: 0.01 - 5.15) in favour of indwelling catheterisation.
Outcome: bacteriuria
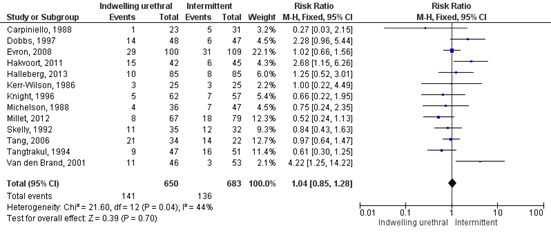
Kidd performed a meta-analysis including 13 trials (n=1333) and calculated a pooled risk ratio of RR 1.04 (95% CI 0.85 to 1.28) in favor of intermittent catheterisation. This means that fewer patients that use intermittent catheterisation experienced bacteriuria compared to patients with an indwelling urethral catheter. This is not a clinically relevant difference. Subgroup analysis (gender, type of surgery, with or without antibiotic prophylaxis, moment of collection of urine sample) show different results (six in favor of intermittent catheterisation, four in favor of indwelling catheter).
Figure 3: Indwelling urethral catheterisation versus intermittent catheterisation (outcome bacteriuria)
- Comparison intermittent catheterisation versus suprapubic catheterisation
Outcome: symptomatic UTI
Kidd (2015) described one trial (n=72) that compared suprapubic and intermittent urethral catheterisation and reported symptomatic UTI (Dixon 2010). More participants developed UTI in the suprapubic catheter group than in the intermittent urethral group (10/36 for suprapubic versus 6/36 for intermittent), risk ratio 1.67 (95% CI: 0.68 - 4.10). This is not a clinically relevant difference.
Outcome: bacteriuria
Kidd (2015) described two trials (n=246) that reported asymptomatic bacteriuria (Jannelli 2007; Naik 2005). The pooled risk ratio was 0.52 (95% CI 0.20 to 1.3) in favour of a suprapubic catheter with moderate heterogeneity (I2 = 64%). This means that fewer patients with a suprapubic catheter experienced bacteriuria compared to patients that use intermittent catheterisation. This is a clinically relevant difference.
Sub-question 3 When should a urinary catheter be removed?
Outcome: symptomatic UTI
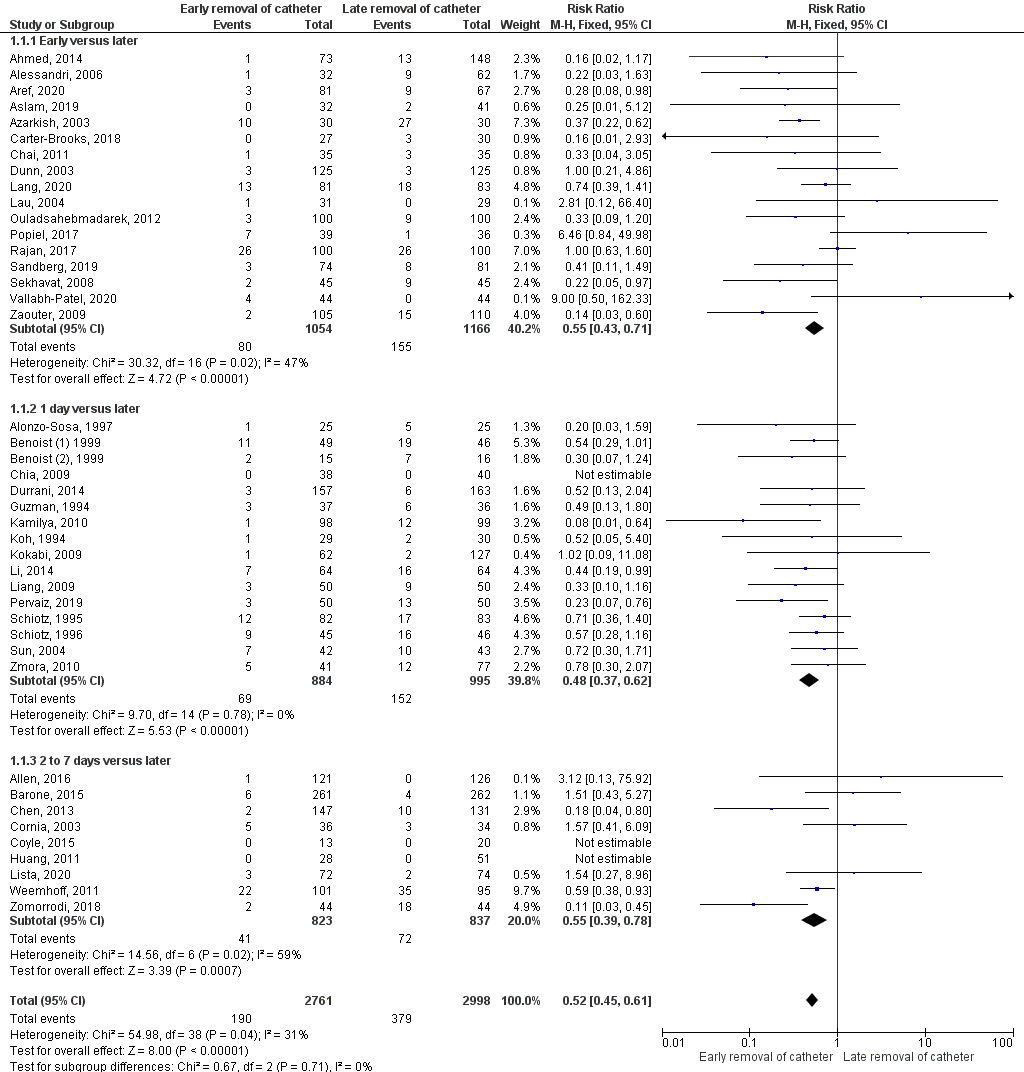
Ellahi (2021) conducted a meta-analysis including 41 trials (n=5759) and compared the length of time the catheter is left in place (shorter versus longer) for patients with an intended duration of urethral catheterisation of 14 days or less. Ellahi calculated a pooled risk ratio of RR 0.52 (95% CI: 0.45 - 0.61) in favour of shorter duration. Participants who had an indwelling urethral catheter for a shorter duration were less likely to develop symptomatic UTI. Heterogeneity was low (I2 = 31%). This is a clinically relevant difference.
Ellahi performed a subgroup analysis on three subgroups:
- Early (<8 hours after surgery) versus later removal: RR 0.55 (95% CI 0.43 to 0.71);
- 1 day versus later: RR 0.48 (95% CI 0.37 to 0.62);
- 2 to 7 days versus later: RR 0.55 (95% CI 0.39 to 0.78).
For all three subgroups, participants who had an indwelling urethral catheter for a shorter duration were less likely to develop symptomatic UTI.
Post-hoc subgroup analysis based on antibiotic prophylaxis did not reveal any heterogeneity between the subgroups (test for subgroup differences: P = 0.26, I2 = 21%, overlapping 95% CIs).
Figure 4: Early versus later removal of catheter (outcome symptomatic UTI)
Outcome: bacteriuria
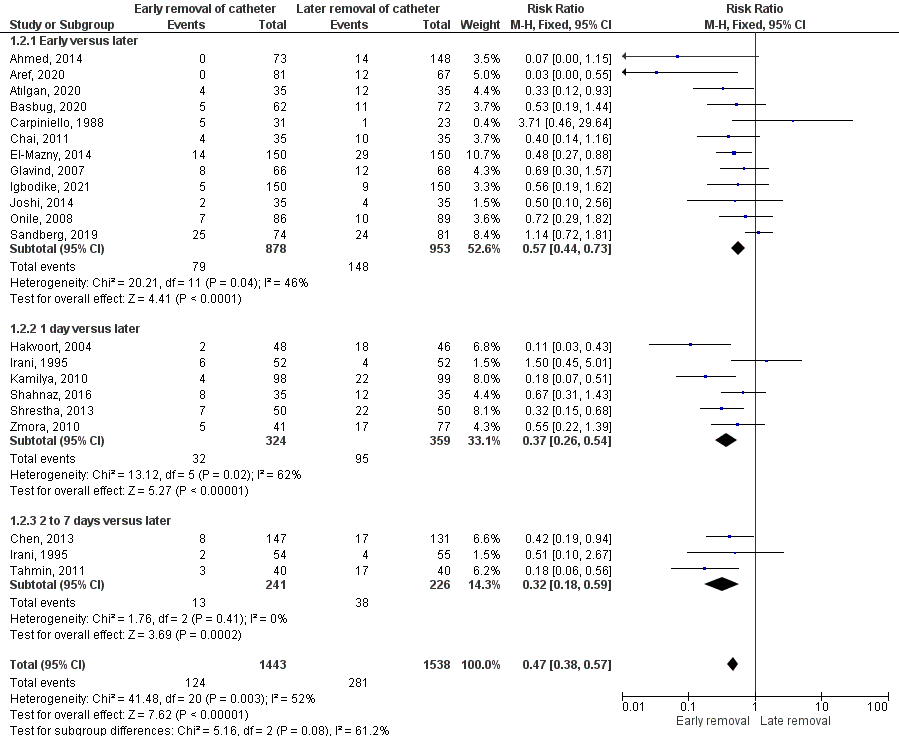
We calculated a pooled risk ratio including 20 trials (Ellahi, 2020; Atılgan, 2020; Igbodike, 2021) (n=2981) for the outcome measure bacteriuria. The pooled risk ratio is 0.47 (95% CI 0.38 to 0.57) in favour of shorter duration. Participants who had indwelling urethral catheterisation for a shorter duration were less likely to develop asymptomatic bacteriuria. This is a clinically relevant difference. Heterogeneity was moderate (I2 = 52%).
We performed a subgroup analysis on three subgroups:
- Early (<8 hours after surgery) versus later removal: RR 0.57 (95% CI 0.44 to 0.73);
- 1 day versus later: RR 0.37 (95% CI 0.26 to 0.54) in favour of ‘1 day’;
- 2 to 7 days versus later: RR 0.32 (95% CI 0.18 to 0.59) in favour of ‘2 to 7 days’.
For all three subgroups, participants who had an indwelling urethral catheter for a shorter duration were less likely to develop bacteriuria.
Figure 5: Early versus later removal of catheter (outcome bacteriuria)
Level of evidence of the literature
- What are the indications for a transurethral catheter?
Not applicable. - What are the alternatives for a transurethral catheter?
-
Urinary tract infection
Comparison Indwelling urethral catheter versus suprapubic catheter
The level of evidence regarding the outcome measure urinary tract infection started at high and was downgraded by three levels to very low because of study limitations (-1; risk of bias: random sequence generation unclear in 3/5 trials; allocation concealment unclear in all 5 trials; participants and personnel not blinded) and imprecision (-2; Confidence interval of pooled effect crosses both thresholds for clinical relevance).
Comparison Indwelling urethral catheterisation versus intermittent catheterisation
The level of evidence regarding the outcome measure urinary tract infection started at high and was downgraded by three levels to very low because of study limitations (-1; risk of bias: Random sequence generation is unclear in 1 of 2 trials. Allocation concealment is unclear in 1 trial and judged to be high risk for the other. Participants and personnel not blinded.); inconsistency (-2;conflicting results of the two studies).
Comparison intermittent catheterisation versus suprapubic catheterisation
The level of evidence regarding the outcome measure urinary tract infection started at high and was downgraded by three levels because of imprecision (-3; Confidence interval of pooled effect crosses both thresholds for clinical relevance) to very low.
- Bacteriuria
Comparison Indwelling urethral catheter versus suprapubic catheter
The level of evidence regarding the outcome measure bacteriuria started at high and was downgraded by two levels to low because of study limitations (-1; risk of bias: random sequence generation unclear in 9/19 trials and high risk in 2/19 trials; allocation concealment unclear in 15/19 trials and high risk in 2/19 trials; participants and personnel not blinded), and publication bias (-1; trials with low sample size or negative results were not represented).
Comparison Indwelling urethral catheterisation versus intermittent catheterisation
The level of evidence regarding the outcome measure bacteriuria started at high and was downgraded by three levels to very low because of study limitations (-1; risk of bias: random sequence generation unclear in 6/13 trials and high risk in 3/13 trials; allocation concealment unclear in 4/13 trials and high risk in 4/13 trials; participants and personnel not blinded) and imprecision (-2; Confidence interval of pooled effect crosses threshold for clinical relevance and 0).
Comparison intermittent catheterisation versus suprapubic catheterisation
The level of evidence regarding the outcome measure bacteriuria started at high and was downgraded by three levels to very low because of study limitations (-1: risk of bias: random sequence generation and allocation concealment unclear in ½ trials; participants and personnel not blinded), conflicting results (-1; inconsistency); imprecision (-1; very wide confidence interval).
-
When should a urinary catheter be removed?
-
Urinary tract infection
The level of evidence regarding the outcome measure urinary tract infection started at high and was downgraded by one level to moderate because of study limitations (-1; risk of bias: unclear risk of selection bias and detection bias, no blinding of participants, blinding of outcome assessors unclear). -
Bacteriuria
The level of evidence regarding the outcome measure urinary tract infection started at high and was downgraded by one level to moderate because of study limitations (-1; risk of bias: unclear risk of selection bias and detection bias, no blinding of participants, blinding of outcome assessors unclear).
-
1. What are the indications for a transurethral catheter?
Not applicable.
2. What are the alternatives for a transurethral catheter?
1.1 Urinary tract infection
|
Very low GRADE (Grading Recommendations Assessment, Development and Evaluation ) |
The evidence is very uncertain about the effect of an indwelling urethral catheter on urinary tract infections when compared with a suprapubic catheter. The evidence is very uncertain about the effect of an indwelling urethral catheter on urinary tract infections when compared with intermittent catheterisation. The evidence is very uncertain about the effect of an intermittent catheterisation on urinary tract infections when compared with suprapubic catheterisation. Source: Kidd (2015) |
|---|
1.2 Bacteriuria
|
Low GRADE |
The evidence suggests that the use of a suprapubic catheter is associated with less bacteriuria when compared with an indwelling urethral catheter. Source: Kidd (2015) |
|---|
|
Very low GRADE |
The evidence is very uncertain about the effect of an indwelling urethral catheter on bacteriuria when compared with intermittent catheterisation. The evidence is very uncertain about the effect of an intermittent catheterisation on bacteriuria when compared with suprapubic catheterisation. Source: Kidd (2015) |
|---|
3. When should a urinary catheter be removed?
1.3 Urinary tract infection
|
Moderate GRADE |
Early removal of a catheter probably reduces urinary tract infections when compared with later removal. Source: Ellahi (2020) |
|---|
1.4 Bacteriuria
|
Moderate GRADE |
Early removal of a catheter probably reduces bacteriuria when compared with later removal. Source: Ellahi (2020); Atılgan (2020); Igbodike (2021) |
|---|
Bentvelsen RG, Bruijning ML, Chavannes NH, Veldkamp KE. Reducing Inappropriate Urinary Catheter Use by Involving Patients Through the Participatient App: Before-and-After Study. JMIR Form Res. 2022 Apr 4;6(4):e28983. Doi: 10.2196/28983. PMID: 35377323; PMCID: PMC9016499.
van Doorn T, Berendsen SA, Scheepe JR, Blok BFM. Single use versus reusable catheters in intermittent catheterisation for treatment of urinary retention: a protocol for a multicentre, prospective, randomised controlled, non-inferiority trial (COMPaRE). BMJ Open. 2022 Apr 11;12(4):e056649. doi: 10.1136/bmjopen-2021-056649. PMID: 35410930; PMCID: PMC9003620.
Ellahi A, Stewart F, Kidd EA, Griffiths R, Fernandez R, Omar MI. Strategies for the removal of short-term indwelling urethral catheters in adults. Cochrane Database Syst Rev. 2021 Jun 29;6(6):CD004011. Doi: 10.1002/14651858.CD004011.pub4. PMID: 34184246; PMCID: PMC8240009.
Hilt EE, McKinley K, Pearce MM, Rosenfeld AB, Zilliox MJ, Mueller ER, Brubaker L, Gai X, Wolfe AJ, Schreckenberger PC. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. J Clin Microbiol. 2014 Mar;52(3):871-6. Doi: 10.1128/JCM.02876-13. Epub 2013 Dec 26. PMID: 24371246; PMCID: PMC3957746.
Igbodike EP, Awowole IO, Kuti OO, Ajenifuja KO, Eleje GU, Olateju SO, Olopade BO, Ijarotimi OA, Irek EO, Igbodike NT, Ayegbusi OE, Ikechebelu JI, Okpala BC, Loto OM, Fehintola AO, Ajiboye AD, Fajobi O, Abuchi CS, Onwudiegwu UU (Universiteit Utrecht), Fasubaa OB, Orji EO, Makinde ON, Owolabi AT, Adeyemi AB. Eight-hour versus 24-h urethral catheter removal following elective caesarean section for reducing significant bacteriuria: A randomized controlled trial. Womens Health (Lond). 2021 Jan-Dec;17:17455065211060637. Doi: 10.1177/17455065211060637. PMID: 34812114; PMCID: PMC8628312.
Kidd EA, Stewart F, Kassis NC, Hom E, Omar MI. Urethral (indwelling or intermittent) or suprapubic routes for short-term ospitalizedon in ospitalized adults. Cochrane Database Syst Rev. 2015 Dec 10;2015(12):CD004203. Doi: 10.1002/14651858.CD004203.pub3. PMID: 26661940; PMCID: PMC8612698.
Laan BJ (A.), Maaskant JM, Spijkerman IJB, Borgert MJ, Godfried MH, Pasmooij BC, Opmeer BC, Vos MC, Geerlings SE. De-implementation strategy to reduce inappropriate use of intravenous and urinary catheters (RICAT): a multicentre, prospective, interrupted time-series and before and after study. Lancet Infect Dis. 2020 Jul;20(7):864-872. doi: 10.1016/S1473-3099(19)30709-1. Epub 2020 Mar 6. PMID: 32151333.
Laan BJ (B.), Vos MC, Maaskant JM, van Berge Henegouwen MI, Geerlings SE. Prevalence and risk factors of inappropriate use of intravenous and urinary catheters in surgical and medical patients. J Hosp Infect. 2020 Aug;105(4):698-704. doi: 10.1016/j.jhin.2020.04.046. Epub 2020 May 16. PMID: 32422310.
Liedl B. Catheter-associated urinary tract infections. Curr Opin Urol. 2001 Jan;11(1):75-9. doi: 10.1097/00042307-200101000-00011. PMID: 11148750.
Maki DG, Tambyah PA. Engineering out the risk for infection with urinary catheters. Emerg Infect Dis. 2001 Mar-Apr;7(2):342-7. doi: 10.3201/eid0702.010240. PMID: 11294737; PMCID: PMC2631699.
Nicolle LE, Gupta K, Bradley SF, Colgan R, DeMuri GP, Drekonja D, Eckert LO, Geerlings SE, Köves B, Hooton TM, Juthani-Mehta M, Knight SL, Saint S, Schaeffer AJ, Trautner B, Wullt B, Siemieniuk R. Clinical Practice Guideline for the Management of Asymptomatic Bacteriuria: 2019 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2019 May 2;68(10):1611-1615. doi: 10.1093/cid/ciz021. PMID: 31506700.
PREZIES Prevalentieonderzoek Ziekenhuizen – versie: 2023. PROTOCOL EN DATASPECIFICATIES.
Siddiqui H, Nederbragt AJ, Lagesen K, Jeansson SL, Jakobsen KS. Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons. BMC Microbiol. 2011 Nov 2;11:244. doi: 10.1186/1471-2180-11-244. PMID: 22047020; PMCID: PMC3228714.
Bekijk de Evidence-tabellen:
|
Reference |
Reason for exclusion |
|
Lang P, Quezada Y, Whiteside J. Urinary Catheter Management Approaches Among Women Undergoing Benign Gynecologic Surgery: A Randomized Trial. Female Pelvic Med Reconstr Surg. 2020 Dec 1;26(12):e73-e77. doi: 10.1097/SPV.0000000000000781. PMID: 31688528. |
Patient reported UTI in a survey.
|
|
Cooper FP, Alexander CE, Sinha S, Omar MI. Policies for replacing long-term indwelling urinary catheters in adults. Cochrane Database Syst Rev. 2016 Jul 26;7(7):CD011115. doi: 10.1002/14651858.CD011115.pub2. PMID: 27457774; PMCID: PMC6457973. |
Wrong I/C (antibiotics vs no antibiotics, sterile water vs chlorhexidine, replacement monthly vs as needed). |
|
Li MX, Cheng P, Yao L, Li HJ, Xun YQ, Yan PJ, Han CW, Lu CC, He WB, Wang M, Liu R, Guo TK, Yang KH. Suprapubic tube compared with urethral catheter drainage after robot-assisted radical prostatectomy: A systematic review and meta-analysis. Asian J Surg. 2019 Jan;42(1):71-80. doi: 10.1016/j.asjsur.2018.08.004. Epub 2018 Sep 26. PMID: 30266465. |
No additional studies compared with Kidd (2015). Kidd (2015) is included in the literature summary. |
|
Zhang W, Liu A, Hu D, Xue D, Li C, Zhang K, Ma H, Yan S, Pan Z. Indwelling versus Intermittent Urinary Catheterization following Total Joint Arthroplasty: A Systematic Review and Meta-Analysis. PLoS One. 2015 Jul 6;10(7):e0130636. doi: 10.1371/journal.pone.0130636. PMID: 26146830; PMCID: PMC4492963. |
Low quality review on alternatives. Better review available (Ellahi, 2020). |
|
Nollen JM, Pijnappel L, Schoones JW, Peul WC, Van Furth WR, Brunsveld-Reinders AH. Impact of early postoperative indwelling urinary catheter removal: A systematic review. J Clin Nurs. 2022 Jun 8. doi: 10.1111/jocn.16393. Epub ahead of print. PMID: 35676776. |
Better review available (Ellahi, 2020). |
|
Huang H, Dong L, Gu L. The timing of urinary catheter removal after gynecologic surgery: A meta-analysis of randomized controlled trials. Medicine (Baltimore). 2020 Jan;99(2):e18710. doi: 10.1097/MD.0000000000018710. PMID: 31914080; PMCID: PMC6959902. |
Better review available (Ellahi, 2020). |
|
Castelo M, Sue-Chue-Lam C, Kishibe T, Acuna SA, Baxter NN. Early urinary catheter removal after rectal surgery: systematic review and meta-analysis. BJS Open. 2020 Aug;4(4):545-553. doi: 10.1002/bjs5.50288. Epub 2020 May 7. PMID: 32379937; PMCID: PMC7397370.
|
Better review available (Ellahi, 2020). |
|
Xie N, Hu Z, Ye Z, Xu Q, Chen J, Lin Y. A systematic review comparing early with late removal of indwelling urinary catheters after pelvic organ prolapse surgery. Int Urogynecol J. 2021 Jun;32(6):1361-1372. doi: 10.1007/s00192-020-04522-y. Epub 2020 Sep 4. PMID: 32886172. |
Better review available (Ellahi, 2020). |
|
Lang P, Quezada Y, Whiteside J. Urinary Catheter Management Approaches Among Women Undergoing Benign Gynecologic Surgery: A Randomized Trial. Female Pelvic Med Reconstr Surg. 2020 Dec 1;26(12):e73-e77. doi: 10.1097/SPV.0000000000000781. PMID: 31688528. |
Patient reported UTI in a survey.
|
Bekijk de Risk-of-bias-tabel:
Bijlagen
| Begrip | Definitie |
|---|---|
|
UWI |
Urinary tract infection/urineweginfectie. |
|
CAUTI |
Catheter-associated urinary tract infection/kathetergerelateerde urineweginfectie. |
|
Algemene voorzorgsmaatregelen |
Maatregelen die bij elke patiënt ongeacht zijn/haar infectiestatus of kolonisatie van toepassing zijn. Deze maatregelen staan beschreven in de SRI (Samenwerkingsverband Richtlijnen Infectiepreventie )-richtlijnen Handhygiëne & persoonlijke hygiëne medewerker, Persoonlijke beschermingsmiddelen, Reiniging & desinfectie van ruimten en Accidenteel bloedcontact. |
|
Antibioticaprofylaxe |
Een antibioticumgift ter voorkoming van een infectie bij een ingreep of instrumentatie van de urinewegen, in principe eenmalig. |
|
Bacteriurie |
Aantoonbare bacteriën in de urine zonder klachten. |
|
Blaaskatheter |
En slangetje dat via de urethra (transurethrale katheter) of via de buik (suprapubische katheter) in de blaas wordt gebracht en de urine afvoert. |
|
Urineweginfectie |
Door micro-organismen geïnduceerde ontstekingsreactie van nier, pyelum, ureter, blaas, urethra, prostaat, testes en/of epididymis. |
|
Suprapubische katheter |
Een suprapubische katheter is een katheter die via de buik, boven het schaambeen langs, in de blaas wordt gebracht. |
|
Transurethrale katheter |
Een slangetje dat voor langere tijd via de urethra (plasbuis) in de blaas wordt gebracht om urine uit uw blaas te laten lopen. |
|
Intermitterend katheteriseren |
Intermitterend katheteriseren is het herhaaldelijk, met tussenpozen, legen van de blaas met een eenmalige katheter die wordt ingebracht via de urinebuis. |
|
Urineopvangzak |
Een urineopvangzak wordt gebruikt om de urine uit de blaas op te vangen wanneer een katheter is ingebracht. |
|
Nachtzak |
Een urineopvangzak met grote inhoud die aan het bed van de patiënt bevestigd wordt. |
|
Beenzak |
Een beenzak/dagzak is een urineopvangzak die met banden of een fixatiekous aan het been wordt bevestigd. |
|
Dagzak |
Zie beenzak. |
Werkwijze
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een blaaskatheter. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere WIP-richtlijn Blaaskatheterisatie op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door NOV (Nederlandse Orthopaedische Vereniging ), NVZ, Verenso (Vereniging van specialisten ouderengeneeskunde ), VHIG (Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg ), PFNL (Patiëntfederatie Nederland ), NVMM (Nederlandse Vereniging voor Medische Microbiologie ), NVOG (Nederlandse Vereniging voor Obstetrie en Gynaecologie ), NVU, VRA (Nederlandse Vereniging van Revalidatieartsen ), VCCN via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Ook definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|---|---|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID (Minimal Clinically Important Difference )). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|---|---|---|
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland (PFNL) voor de knelpunteninventarisatie. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan PFNL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz (Wet kwaliteit, klachten en geschillen zorg ) & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|---|---|---|
|
Indicaties |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het overgrote deel (± 90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
|
Inbrengen |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Dagelijkse verzorging |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het overgrote deel (± 90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht |
|
Katheterwissel |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (> 40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R,Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S,Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in healthcare. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group,2013.
Dit implementatieplan is opgesteld om de implementatie van de aanbevelingen in de richtlijn infectiepreventie Blaaskatheterisatie te borgen. Voor het opstellen van dit plan heeft de werkgroep per ontwikkelde module beoordeeld wat eventueel bevorderende en belemmerende factoren zijn voor het naleven van de aanbevelingen en wat eventueel nodig is om de aanbevolen infectiepreventiemaatregelen in Nederland te implementeren.
Werkwijze
De werkgroep heeft per aanbeveling binnen de modules geïnventariseerd:
- wat een realistische termijn voor implementatie is;
- de verwachtte effect van implementatie op de zorgkosten;
- randvoorwaarden om de aanbeveling tijdig te implementeren;
- mogelijk barrières voor implementatie;
- te ondernemen acties voor (bevordering van) implementatie;
- verantwoordelijke partij voor de te ondernemen acties.
Hieronder is een tabel (tabel 1) opgenomen met alle modules uit deze richtlijn met daarbij de bijhorende implementatietermijn, verwacht effect op kosten, mogelijke barrières voor implementatie, te ondernemen acties voor implementatie en verantwoordelijken voor de acties.
Tabel 1 Implementatieplan
|
Module |
Tijdspad voor implementatie |
Verwacht effect op de kosten |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijke voor acties3
|
|---|---|---|---|---|---|
|
Indicaties |
<1 jaar |
Geen, betreft grotendeels bestaand beleid |
Geen |
Verspreiden richtlijn en voorlichten zorgmedewerkers |
Professionals |
|
Inbrengen |
<1 jaar |
Kostenreductie doordat beleid is aangepast naar schoon inbrengen i.p.v. steriel |
Weerstand tegen verandering van zorgverleners die gewend zijn om steriel te werken |
Verspreiden richtlijn en voorlichten zorgmedewerkers |
Professionals |
|
Dagelijkse verzorging |
<1 jaar |
Geen, dit betreft grotendeels bestaand beleid |
Geen |
Verspreiden richtlijn en voorlichten zorgmedewerkers |
Professionals |
|
Katheterwissel |
<1 jaar |
Geen, dit betreft grotendeels bestaand beleid |
Geen |
Verspreiden richtlijn en voorlichten zorgmedewerkers |
Professionals |
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de participerende wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten.
Termijn voor implementatie
Omdat de aanbevelingen in het algemeen nauw aansluiten bij de huidige klinische praktijk, voorziet de werkgroep nauwelijks belemmeringen voor implementatie. Als men ervan uitgaat dat alle betrokken zorgprofessionals vanaf autorisatie van deze richtlijn (voorzien begin 2024) binnen een jaar op de hoogte gesteld worden van deze richtlijn, is implementatie van de aanbevelingen vanaf een jaar later (begin 2025) realistisch en haalbaar.
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijke verenigingen/beroepsorganisaties
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn door er over te vertellen op congressen.
- Ontwikkelen van gerichte bijscholing/trainingen om kennisoverdracht tussen medewerkers te faciliteren/stimuleren.
- Ontwikkelen en aanpassen van infectiepreventieprotocollen.
De lokale vakgroepen/individuele medisch professionals
- Het bespreken van de aanbevelingen in de multidisciplinaire teamoverleggen, vakgroepoverleggen en relevante lokale werkgroepen.
- Aanpassen lokale infectiepreventieprotocollen.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
Samenwerkingsverband Richtlijnen Infectiepreventie (SRI):
- Toevoegen van de richtlijn aan de SRI (Samenwerkingsverband Richtlijnen Infectiepreventie )-website.
- Toevoegen van richtlijn aan richtlijnendatabase.
- Het implementatieplan wordt in de bijlage opgenomen, zodat deze voor op een voor alle partijen goed te vinden is.
- De kennislacunes worden opgenomen in de bijlagen.
Indicatoren
Voor deze richtlijn zijn geen indicatoren ontwikkeld.
Tijdens de ontwikkeling van de richtlijn Blaaskatheterisatie is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven waar wetenschappelijke kennis beperkt is en dus op welke vlakken nader onderzoek gewenst is.
Module 1 Indicaties
Wat is het effect van intermitterend katheteriseren op het ontstaan van een urineweginfectie en bacteriurie in vergelijking met een verblijfskatheter?
Wat is het effect van een suprapubische katheter op het ontstaan van een urineweginfectie en bacteriurie in vergelijking met een verblijfskatheter?
Zijn er verschillende uitkomsten voor verschillende patiëntengroepen bij de twee bovenstaande vragen (bijvoorbeeld patiënten met neurogene blaas na operatie of oudere patiënten)?
Module 2 Inbrengen
Bij module 2 zijn geen kennislacunes geformuleerd.
Module 3 Dagelijkse verzorging
- Wat is het effect van hergebruik van een urine(nacht)zak ten opzichte van eenmalig gebruik van een urine(nacht)zak bij patiënten met een transurethrale katheter op het ontstaan van een urineweginfectie of bacteriurie?
- Wat is het effect van het aansluiten van een katheterzak met een hoog volume (nachtzak) op de afvoerklep van een katheterbeenzak in vergelijking met het verwisselen van de dag- en nacht-urinezak voor de nacht bij patiënten met een transurethrale katheter op het optreden van een urineweginfectie of bacteriurie?
Module 4 Katheterwissel
De werkgroep ziet het ontbreken van bewijs voor een wisselstrategie van een urinekatheter in het voorkomen van infecties bij patiënten met en zonder risicofactoren als kennislacune. Studies naar een vergelijking van een vastgesteld wisselmoment op vier weken versus zes weken versus twaalf weken zouden kunnen voorzien in bewijsvoering.
Bekijk de pdf met de notulen van de schriftelijke knelpunteninventarisatie voor deze richtlijn.